Trypsine En tant qu'enzyme du pancréas, il est responsable de la dégradation ultérieure des protéines alimentaires. Il fonctionne dans la gamme fortement alcaline. Une carence en trypsine entraîne une carence en protéines dans le corps en raison d'une digestion altérée des protéines.
Qu'est-ce que la trypsine?
La trypsine est une protéase qui continue la dégradation des protéines dans la zone alcaline de l'intestin grêle. Dans l'estomac, la dégradation des protéines commence dans l'environnement acide par l'enzyme pepsine. L'enzyme trypsine se compose de trois composants.
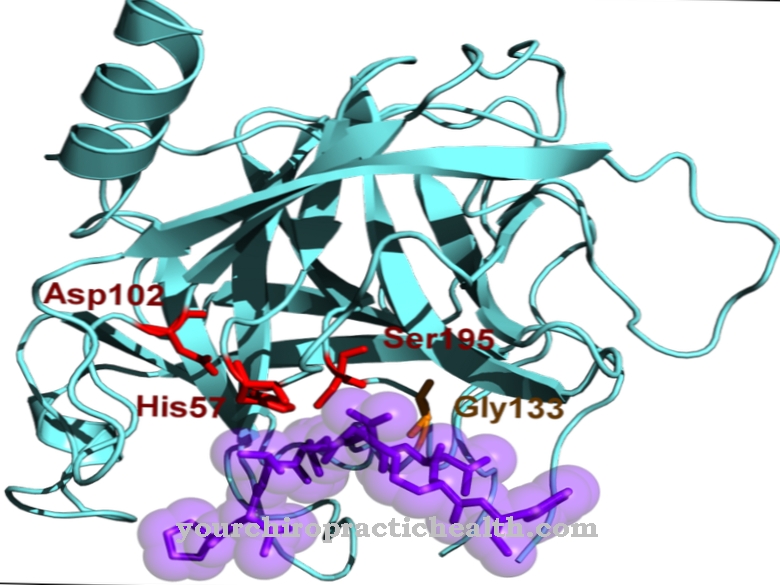
Ce sont la trypsine-1 en tant que cation, la trypsine-2 en tant qu'anion et la trypsine-4. Les deux tiers de l'enzyme sont constitués de trypsine-1 et d'un tiers de trypsine-2. La trypsine-4 ou mésotrypsine ne se trouve qu'en petites quantités. La trypsine est une endoprotéase. Il ne divise une protéine qu'à certains endroits. C'est aussi une sérine protéase. Son centre actif contient la triade catalytique de l'acide aspartique, de l'histidine et de la sérine. Il sépare préférentiellement les protéines alimentaires au niveau des acides aminés basiques lysine, arginine et cystéine modifiée.
La trypsine est produite à partir du précurseur du zymogène trypsinogène à l'aide de l'action catalytique de l'enzyme intestinale entéropeptidase. L'enzyme se compose de 224 acides aminés. La trypsine développe son effet optimal à un pH de 7 à 8.
Fonction, effet et tâches
La tâche de la trypsine est de poursuivre la dégradation des protéines qui a déjà commencé dans l'estomac dans la gamme alcaline. Dans l'estomac, la pré-digestion des protéines alimentaires par l'enzyme similaire pepsine commence dans la plage acide.
Ici aussi, les chaînes protéiques sont rompues à certains endroits. Alors que cette division des protéines a lieu dans l'estomac sur des acides aminés aromatiques tels que la phénylalanine, les protéines et les polypeptides sont séparés par la trypsine sur les acides aminés basiques lysine et arginine ainsi que sur la cystéine modifiée. Une autre différence avec la pepsine est que la trypsine développe son effet optimal dans la gamme alcaline à une valeur de pH de 7 à 8. La trypsine activée convertit également d'autres zymogènes tels que le chymotrypsinogène, la pro-élastase, la procarboxypeptidase et d'autres enzymes inactives en enzymes actives.
La conversion commence immédiatement après la libération de trypsine. Les autres protéases du pancréas sont la chymotrypsine, la carboxypeptidase ou l'élastine. De plus, la trypsine s'active en convertissant le trypsinogène. Les enzymes pancréatiques sont initialement sous leur forme inactive pour ne pas décomposer le pancréas par auto-digestion. Ce n'est que lorsque les préformes inactives sont sécrétées qu'elles peuvent être activées par division. Tout d'abord, la conversion du trypsinogène en trypsine est catalysée par l'entéropeptidase. C'est la seule fonction de l'entéropeptidase.
Un hexamère avec l'acide aminé terminal lysine est séparé du trypsinogène. Puisque la trypsine se sépare également des chaînes polypeptidiques sur la lysine basique, elle catalyse maintenant également sa propre activation et en même temps l'activation des autres zymogènes. Avec les enzymes chymotrypsine et élastase, il divise les protéines plus grosses dans l'intestin grêle et les peptones (chaînes polypeptidiques) produites par l'action de la pepsine en tri- et dipeptides. Ces peptides plus petits sont ensuite décomposés en acides aminés à l'aide d'autres enzymes. En particulier, la trypsine contribue également à la dégradation de l'acide aminé méthionine. La lysine stimule, entre autres, la formation de trypsine.
Éducation, occurrence, propriétés et valeurs optimales
La trypsine est une enzyme endogène utilisée pour digérer les protéines alimentaires. C'est pourquoi il est toujours sécrété par le pancréas peu de temps après avoir mangé. Cependant, l'enzyme peut également être obtenue à partir de sources animales et utilisée en médecine. L'effet de séparation des protéines peut être utilisé, entre autres, pour décomposer les propres complexes protéiques du corps. C'est ainsi que les complexes immuns peuvent être résolus dans les maladies auto-immunes.
L'inflammation du système musculo-squelettique peut également être bien traitée avec la trypsine. Il active également l'enzyme plasmine du plasminogène. La plasmine dissout la fibrine lorsqu'il y a une forte formation de thrombus. La thrombose peut être traitée ou même prévenue à l'aide de la trypsine. La trypsine favorise également la digestion lorsqu'elle est prise pendant les repas. S'il est appliqué 1 à 2 heures avant ou après un repas, il développe ses effets anti-inflammatoires.
Maladies et troubles
Dans le cadre d'une insuffisance pancréatique, la synthèse d'enzymes digestives comme la trypsine peut être restreinte. La conséquence est le développement de l'indigestion. En plus des protéases, le pancréas produit également des lipases et des amylases.
Si les enzymes manquent, les composants alimentaires ne sont plus digérés et se retrouvent dans le gros intestin. Si, par exemple, il y a un manque de trypsine, les protéines de l'alimentation ne peuvent plus être correctement digérées. Les bactéries putréfactives s'installent dans le gros intestin et décomposent les protéines de manière anaérobie. Il existe des problèmes digestifs massifs avec des flatulences, de la diarrhée et des douleurs abdominales. De plus, la formation réduite d'acides aminés entraîne une carence en protéines et une malnutrition malgré un apport alimentaire suffisant. Cependant, les enzymes peuvent également être fournies de l'extérieur.
Cependant, il existe également des urgences médicales dans lesquelles les propres enzymes du corps telles que la trypsine digèrent le pancréas lui-même. Cela peut se produire si les canaux biliaire et pancréatique sont obstrués. La trypsine est libérée, mais ne peut pas pénétrer dans l'intestin grêle par le blocage pancréatique. Si le canal pancréatique n'est pas ouvert dans cette situation d'urgence aiguë, l'issue sera fatale en raison de l'auto-dissolution du pancréas. Même avec des tumeurs pancréatiques, le canal pancréatique peut être complètement ou partiellement fermé. L'action des sucs digestifs dans le pancréas se manifeste par une pancréatite chronique ou aiguë.
Un manque de trypsine peut également être causé par une mutation. En outre, il existe également des formes héréditaires de pancréatite lorsque la dégradation de la trypsine est altérée.

.jpg)




.jpg)




.jpg)