le Xanthine oxydase est responsable de la conversion en acide urique lors de la décomposition des purines. Une carence ou une inhibition de l'enzyme entraîne une diminution des taux d'acide urique dans le sang.
Qu'est-ce que la xanthine oxydase?
La xanthine oxydase est une enzyme qui active (catalyse) la réaction de l'hypoxanthine via la xanthine en acide urique. Il contient une partie non protéique en tant que groupe dit prothétique (grec, prothétique, en annexe), qui est responsable de la réactivité.
C'est un dérivé de la flavine. La xanthine oxydase est l'une des enzymes flavines. Il a également du fer et du molybdène dans le centre actif. En 1902, l'enzyme a été décrite pour la première fois comme un composant du lait de vache par le biochimiste F. Schardinger, de sorte qu'elle s'appelait auparavant l'enzyme Schardinger. Sous l'action de cette enzyme, la couleur du colorant bleu de méthylène change, ce qui peut être utilisé comme réaction de détection typique pour distinguer le lait cru du lait traité thermiquement.
L'enzyme est détruite à haute température. Le changement de couleur est dû au fait que les enzymes présentes dans le lait cru (comme la xanthine oxydase) en présence de formaldéhyde décolorent le bleu de méthylène lorsqu'elles sont exposées à l'air.
Fonction, effet et tâches
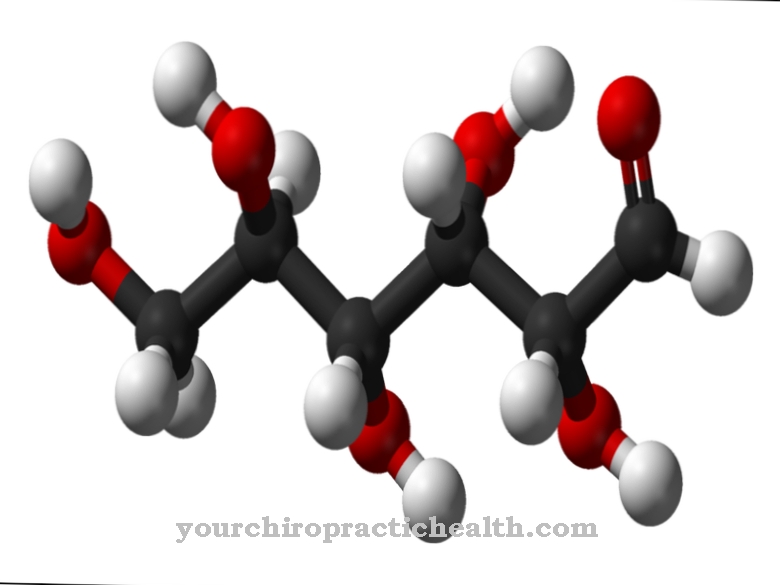
La tâche la plus connue de la xanthine oxydase est la formation d'acide urique dans le métabolisme des purines. Les purines sont présentes dans chaque cellule. Ils font partie des bases nucléiques adénosine et guanine, à partir desquelles, avec les bases pyrimidiniques cytosine et thymine (ou uracile), sont construits les acides nucléiques ADN et ARN.
L'information génétique dans les différentes cellules du corps est constituée d'acides nucléiques. Cela s'applique aux humains et aux animaux. Par exemple, les personnes ayant des produits carnés en ingèrent une grande quantité sous forme d'aliments d'origine animale. Si les propres cellules du corps coulent ou si les cellules animales qui pénètrent dans le corps par la nourriture sont dégradées, des acides nucléiques et donc aussi des purines sont produits. Ceux-ci sont convertis en acide urique. Sous l'action de la xanthine oxydase, il se forme d'abord de l'hypoxanthine et, dans une étape ultérieure, de la xanthine, qui est convertie en acide urique et peut être largement excrétée par les reins. Seule une faible proportion d'acide urique quitte le corps par les intestins.
Si le corps accumule de grandes quantités de purine ou si l'excrétion dans l'urine est restreinte, le taux d'acide urique dans le sang augmente. Une deuxième enzyme impliquée dans la dégradation des purines produit également de l'acide urique. Elle est appelée xanthine déshydrogénase, utilise le nicotinamide adénine dinucléotide (NAD) et est l'enzyme prédominante. En revanche, la xanthine oxydase a une sous-unité flavine adénine dinucléotide (FAD). Si l'approvisionnement est insuffisant, par exemple en raison d'un manque de circulation sanguine, les deux enzymes peuvent se convertir l'une en l'autre.
Lorsqu'il est converti sous l'action de la xanthine oxydase, le peroxyde d'hydrogène est également formé comme sous-produit. Le peroxyde d'hydrogène n'est pas lui-même un radical, mais c'est une substance réactive. C'est pourquoi il est rapidement rendu inoffensif par l'action d'autres enzymes (peroxydase, catalase) dans l'organisme.
Éducation, occurrence, propriétés et valeurs optimales
La dégradation de la purine a lieu principalement dans le foie. Dans la membrane muqueuse de l'intestin grêle, l'enzyme est également impliquée dans l'incorporation du fer dans la protéine de transport transferrine. La recherche a montré que l'enzyme se trouve dans les cellules situées dans la paroi interne des vaisseaux sanguins. Dans ce contexte, son influence sur l'évolution des maladies cardiovasculaires et des dommages causés par le stress oxydatif est discutée.
La proportion d'oxydase par rapport à la déshydrogénase en tant que système enzymatique responsable de la conversion des purines en acide urique est de 20%. La forme xanthine déshydrogénase est présente à 80%. La flavine contenue dans la xanthine oxydase est l'une des riboflavines, qui est identique à la vitamine B2. La sous-unité molybdène contenue dans la xanthine oxydase est liée par l'allopurinol, dont la structure est très similaire aux purines. De cette manière, l'enzyme est presque complètement inhibée. L'activité de l'enzyme peut être déterminée indirectement à partir de la quantité d'acide urique formée.
Maladies et troubles
Avec des repas riches en purine ou avec une mort cellulaire accrue, qui se produit, par exemple, pendant un traitement anticancéreux, la réaction de la xanthine oxydase est activée et de plus grandes quantités d'acide urique sont produites. Le niveau d'acide urique dans le sang augmente.
Si l'enzyme est inhibée, la concentration d'acide urique dans le sang diminue. Cet effet est à la base du médicament dans la maladie de la goutte. Dans la goutte, l'augmentation des concentrations d'acide urique entraîne une cristallisation et donc une gêne articulaire. Les médicaments contenant de l'allopurinol sont des préparations standard utilisées pour traiter la goutte. Dans la forme héréditaire de déficit enzymatique, l'activité est réduite en raison de mutations. Cette condition est héritée comme un trait autosomique récessif. L'enfant tombe malade si les deux parents portent un allèle affecté. Une activité réduite de la xanthine oxydase se produit également lorsque le cofacteur de molybdène est déficient car il n'est pas formé en raison d'un défaut.
La xanthine et l'hypoxanthine s'accumulent. Une augmentation significative des taux de xanthine dans le sang et l'apparition de xanthine dans l'urine (xanthineurie) sont perceptibles chez les personnes touchées. Lors de la détermination de la xanthine pour détecter une carence enzymatique, les aliments tels que les grains de café, le thé, le maté ou les pommes de terre doivent être exclus en tant que source de xanthine. Les niveaux d'acide urique, en revanche, sont abaissés. Comme la xanthine n'est pas décomposée et est peu soluble, elle peut former des cristaux. Dans la plupart des cas, la maladie ne présente aucun symptôme. Cependant, d'autres peuvent avoir des problèmes rénaux, des infections des voies urinaires ou du sang dans les urines.
Si des calculs de xanthine se forment lors d'une maladie grave, ils peuvent se déposer dans le tissu rénal ou dans les voies urinaires. Les personnes touchées doivent faire attention à un régime pauvre en purines et à une grande quantité de liquides.

.jpg)




.jpg)



.jpg)

.jpg)