Environ la moitié de toutes les protéines se trouvent dans le corps humain Les glycoprotéines. Les substances jouent un rôle de composants cellulaires ainsi que de substances immunitaires. Ils sont principalement formés dans le cadre de la soi-disant N-glycosylation et peuvent provoquer des maladies graves s'ils ne sont pas assemblés correctement.
Que sont les glycoprotéines?
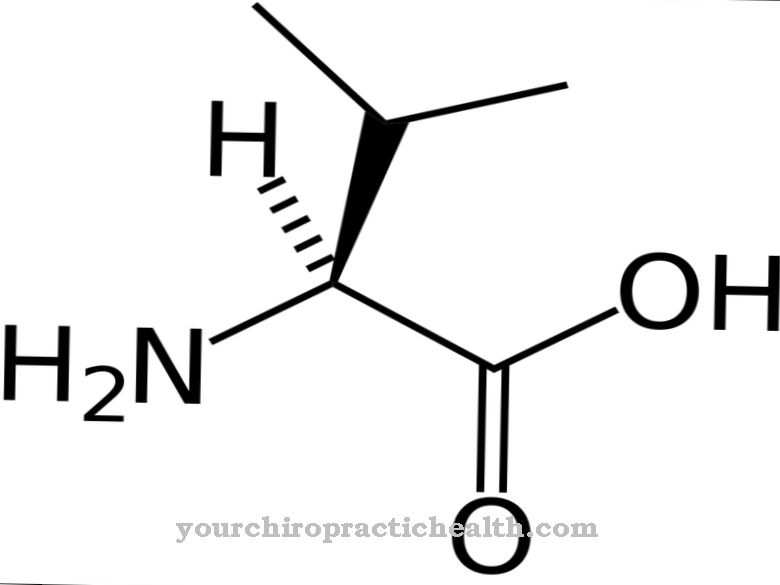
Les glycoprotéines sont des protéines avec des résidus hétéroglycanes ramifiés en forme d'arbre. Ils ont généralement une consistance visqueuse. Les macromolécules contiennent des groupes sucre liés de manière covalente.
Ils sont constitués de monosaccharides tels que le glucose, le fructose, le mannose ou le sucre aminé acétylé. C'est pourquoi ils sont également connus sous le nom d'oligosaccharides liés aux protéines. La liaison covalente peut avoir lieu de différentes manières et correspond soit à une liaison aux acides aminés sérine ou asparagine. Le lien avec la sérine est appelé O- et celui avec la N-glycosylation de l'asparagine. Les glycoprotéines impliquées dans la N-glycosylation varient en taille. Ils correspondent à des monosaccharides, des di- ou oligosaccharides et même des polysaccharides.
Selon leur proportion de monosaccharides, ils sont divisés en glycoprotéines à haute teneur en mannose, complexes et hybrides. Dans le groupe riche en mannose, les résidus de mannose prédominent. Dans le groupe complexe, les saccharides prédominent. Le groupe hybride est un hybride. La teneur en glucides des glycoprotéines se situe entre quelques pour cent pour les ribonucléases et jusqu'à 85 pour cent pour les antigènes des groupes sanguins.
Fonction, effet et tâches
Les glycoprotéines remplissent de nombreuses fonctions dans l'organisme humain. Ils sont un composant structurel des membranes cellulaires et sont également appelés protéines structurales dans ce contexte. Ils se trouvent également dans le mucus et sont utilisés comme lubrifiants dans les liquides.
En tant que protéines membranaires, elles contribuent à l'interaction cellulaire. Certaines glycoprotéines ont également des fonctions hormonales, comme le facteur de croissance hCG. Les substances sont tout aussi importantes que les composants immunologiques sous forme d'immunoglobulines et d'interférons. Toutes les protéines d'exportation et les protéines membranaires du corps étaient encore des glycoprotéines, au moins pendant la biosynthèse. Ils sont particulièrement pertinents pour les réactions de reconnaissance dans le système immunitaire, car ils interagissent avec les cellules T immunologiques et les récepteurs des cellules T. Diverses protéines plasmatiques ont été isolées dans le plasma sanguin humain, dont seules l'albumine et la préalbumine ne contiennent pas de résidus de sucre.
L'abondance des glycoprotéines est incroyable. En fin de compte, presque toutes les protéines et enzymes extracellulaires solubles contiennent des résidus de sucre. En tant qu'hormones, les glycoprotéines ont un effet pléiotrope et sont donc cruciales pour l'activité de divers systèmes organiques. Les hormones TSH, HCG et FSH sont par exemple des glycoprotéines. En tant que protéines membranaires, elles sont représentées dans le rôle de récepteurs ainsi que de transporteurs et de stabilisants. Ils ont un effet stabilisant, en particulier avec les glycolipides. Avec ces substances, ils forment le soi-disant glycocalyx, qui stabilise les cellules sans paroi cellulaire.
Éducation, occurrence, propriétés et valeurs optimales
La formation la plus courante de glycoprotéines est la liaison N-glycosidique ou N-glycosylation en asparagine. Le sucre se lie aux groupes amide d'acide sans azote. La N-glycosylation a lieu dans le réticulum endoplasmique. Les N-glycosides ainsi formés constituent le groupe glycoprotéique le plus pertinent.
Dans la N-glycosylation, le précurseur de sucre se synchronise sur la molécule porteuse dolichol, indépendamment de la séquence d'acides aminés de la protéine cible. Le groupe OH à la fin de la molécule est lié au diphosphate. Un précurseur d'oligosaccharide est formé au niveau du résidu phosphate terminal des molécules. Les sept premiers sucres s'assemblent du côté cytosolique. Deux N-acétyl-glucosamines et cinq résidus de manose sont attachés au phosphate de dolichol. Les nucléotides de sucre GDP-mannose et UDP-N-acétyl-glucosamine apparaissent comme donneurs. Le précurseur est transporté à travers la membrane ER via une protéine de transport.
Le précurseur est ainsi orienté vers l'intérieur du réticulum endoplasmique, où quatre résidus de mannose lui sont ajoutés. De plus, des résidus de glucose sont cultivés. Le précurseur de 14 sucres longs est finalement transféré dans une protéine. Une autre voie de formation des glycoprotéines est la liaison O-glycosidique ou O-glycosylation en sérine, qui a lieu dans l'appareil de Golgi des cellules. Le sucre est lié à un groupe hydroxyle de la sérine. Les valeurs de glycoprotéine sont particulièrement pertinentes par rapport aux protéines plasmatiques, car elles jouent un rôle dans une formule sanguine complète. La liste de toutes les valeurs normales des glycoprotéines individuellement à ce stade irait au-delà de la portée.
Maladies et troubles
Certaines maladies génétiques ont des effets sur la glycosylation. Un groupe de ces maladies est CDG. Les glycoprotéines présentent des valeurs anormales. Les personnes touchées souffrent d'un développement ralenti, lié à des problèmes physiques et mentaux.
Le strabisme peut être un autre symptôme du trouble génétique. Au total, environ 250 gènes différents sont impliqués dans la formation des glocoprotéines. Dans le cas de troubles congénitaux de la glycosylation, les troubles de la fixation des chaînes latérales glucidiques aux protéines sont dus à une disposition génétique. Dans la modification post-traductionnelle, les protéines reçoivent leur pleine fonctionnalité. Dans ce processus, lorsque les enzymes ou les protéines qui construisent les chaînes latérales glucidiques sont anormalement assemblées, la CDG est créée. La N-glycosylation est le plus souvent affectée par des troubles. À ce jour, une trentaine de défauts enzymatiques ont été découverts qui ont un impact sur la N-glycosylation.
Les troubles génétiques d'O-glycosylation sont un peu plus rares. Ils se manifestent par des maladies neuromusculaires multi-systèmes telles que le syndrome de Walker-Warburg. Étant donné que les glycoprotéines assument de nombreuses fonctions dans l'organisme, le tableau clinique est caractérisé par une variété de symptômes. Tous les systèmes organiques peuvent être affectés par des troubles congénitaux de glycosylation. Les troubles du développement psychomoteur sont le principal symptôme. Les anomalies neurologiques sont tout aussi courantes. Les troubles de la coagulation ou les troubles endocriniens ne sont pas non plus rares.



.jpg)

.jpg)






.jpg)