histologie est l'étude du tissu humain. Ce terme est composé de deux termes des langues grecque et latine. «Histos» signifie «tissu» en grec et «logos» signifie «enseignement» en latin.
Quelle est l'histologie?

En histologie, les médecins utilisent des aides techniques comme un microscope optique pour identifier la structure des différentes structures.
L'anatomie microscopique divise les organes en fonction de leurs composants, qui deviennent de plus en plus petits au fur et à mesure que les investigations approfondissent les différentes structures. Les domaines du diagnostic précoce, de la pathologie, de l'anatomie et de la biologie concernent principalement ce domaine médical.
Traitements et thérapies
L'anatomie microscopique divise les organes en trois groupes selon leur taille et leurs composants. L'histologie en tant qu'étude des tissus humains est une composante majeure de la biologie, de la médecine, de l'anatomie et de la pathologie.
La cytologie va déjà plus loin dans les couches tissulaires humaines et traite de la théorie cellulaire et de la composition fonctionnelle. La biologie moléculaire est dédiée aux plus petits composants des cellules humaines, les molécules, également appelées particules. La tâche principale de l'histologie est le diagnostic précoce des tumeurs. En utilisant les meilleures méthodes d'examen, les médecins découvrent s'il y a des changements pathologiques, c'est-à-dire des tumeurs malignes, ou si le tissu est toujours sain et les tumeurs bénignes. De plus, les histologues sont capables de détecter les maladies bactériennes, parasitaires et inflammatoires ainsi que les maladies métaboliques.
La théorie tissulaire constitue également le point de départ des approches thérapeutiques ultérieures basées sur les découvertes histologiques. Les histologues et les pathologistes utilisent l'histologie pour rendre "les petites choses grandes ou visibles". Une partie du tissu malade est prélevée sur le patient avec une excision d'échantillon (biopsie). Cet échantillon de tissu est ensuite examiné par un pathologiste en réalisant des motifs de coupe micromètres. Dans l'étape suivante, ces motifs sont colorés et visualisés au microscope optique. Parfois, un microscope électronique à haute résolution est également utilisé, mais il est principalement utilisé dans la recherche. Avant l'examen, l'histotechnologie traite de la façon dont le tissu est traité. Un assistant technique médical (MTA) est responsable de cette étape. Il fixe le tissu afin d'obtenir une stabilisation.
L'assistant examine le tissu coupé macroscopiquement (avec l'œil), le draine et l'imprègne de paraffine liquide. L'échantillon de tissu est ensuite bloqué dans la paraffine et, à l'étape suivante, une coupe d'un diamètre de 2 à 5 µm est réalisée. Ceci est attaché à la lame de verre et coloré. L'état de la technique de routine est la production d'une préparation FFBE, un "tissu fixé au formol et inclus en paraffine". L'échantillon de tissu est coloré dans une hématoxyline-éosine. Ce processus prend un jour ou deux de la première à la dernière étape. Un examen des tissus qui prend moins de temps est l'examen rapide des coupes. Ceci est toujours fait lorsque le chirurgien a besoin d'informations sur le tissu retiré lors d'une opération.
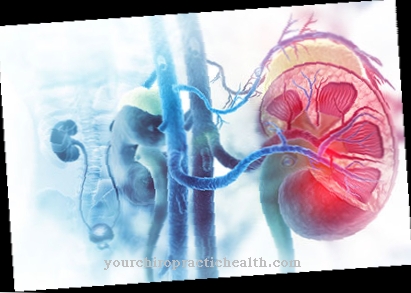
Par exemple, si le chirurgien enlève une tumeur du rein, il a besoin d'informations sur la nature du tissu pendant l'opération. Il a besoin de savoir si la tumeur a déjà été complètement enlevée ou si le tissu malin sur les zones marginales indique d'autres changements pathologiques. Les résultats de l'examen rapide de coupe déterminent le déroulement ultérieur de l'opération. L'échantillon de tissu est congelé en dix minutes à -20 ° C et stabilisé. Une section de 5 à 10 µm est réalisée à l'aide d'un microtome, attaché à une plaque de verre comme une lame et colorée. Les résultats sont immédiatement transmis à la salle d'opération afin que le chirurgien puisse prendre une décision sur la suite de l'opération.
Diagnostic et méthodes d'examen
Les aides techniques les plus importantes en histologie sont les différentes méthodes de coloration. L'histologie classe les structures cellulaires en fonction de leur réaction colorée au colorant utilisé. Ce sont des taches biologiques. Les structures cellulaires neutrophiles ne sont pas colorées par des colorants acides ou basiques.
Les ingrédients sont lipophiles. Les structures cellulaires basophiles fonctionnent avec des colorants basiques tels que l'hématoxyline. Les structures cellulaires acidophiles sont colorées par des colorants basiques et acides tels que l'éosine, la fuchsine acide et l'acide picrique. D'autres structures cellulaires sont nucléophiles et argyrophiles. Les structures cellulaires argyrophiles se lient aux ions argent, à l'ADN nucléophile et aux colorants basiques. La coloration à l'hématoxyline-éosine (coloration HE) est le plus souvent utilisée comme coloration de routine et générale par des machines de coloration contrôlées par ordinateur. Dans le même temps, des colorants manuels spéciaux sont utilisés pour les questions individuelles.
Les études histochimiques présentent une image complexe des processus physico-chimiques en ce qui concerne l'électroadsorption, la diffusion (distribution) et l'adsorption interfaciale en relation avec les distributions de charge dans les molécules de colorant. La liaison ionique crée la principale force de liaison en liant les colorants acides aux protéines basiques. Dans les processus histochimiques, un colorant réagit à un composant tissulaire. Les méthodes histochimiques enzymatiques provoquent le développement de la couleur grâce à l'activité des propres enzymes de la cellule. L'histotechnologie classique est complétée par l'immunohistochimie depuis les années 1980. Cela prouve les propriétés cellulaires sur la base d'une réaction antigène-anticorps. Ceci est rendu visible par une technique multi-sections basée sur la réaction colorée à l'emplacement de l'antigène (protéine).
L'hybridation in situ a été inventée une décennie plus tard. Certaines séquences nucléotidiques sont détectées en faisant fondre de l'ADN double brin et en ancrant spontanément des simples brins à l'aide d'ARN ou d'ADN. Les séquences d'acides nucléiques sont affichées à l'aide de sondes avec marquage au fluorochrome. Cette méthode est connue sous le nom d'hybridation in situ par fluorescence (FISH).
Les méthodes de coloration importantes sont la coloration azan, la réaction au bleu de Prusse, la coloration Golgi, la coloration Gram et la coloration Giemsa. Ces méthodes de coloration fonctionnent avec les noyaux des globules rouges, le cytoplasme rougeâtre, les fibres et collagènes réticulaires bleus, les fibres musculaires rouges, la détection des «ions fer trivalents», l'argenture des ions individuels, la différenciation bactérienne et la différenciation de la coloration des cellules sanguines.






.jpg)
.jpg)




.jpg)


.jpg)