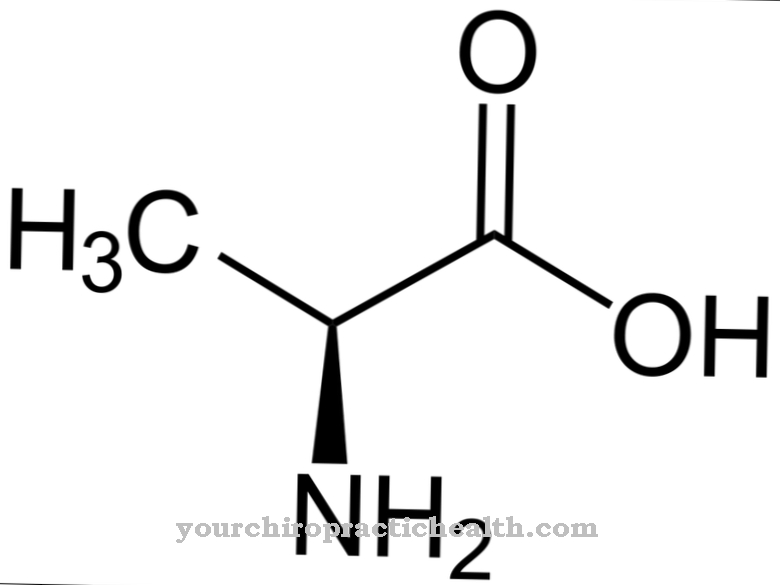
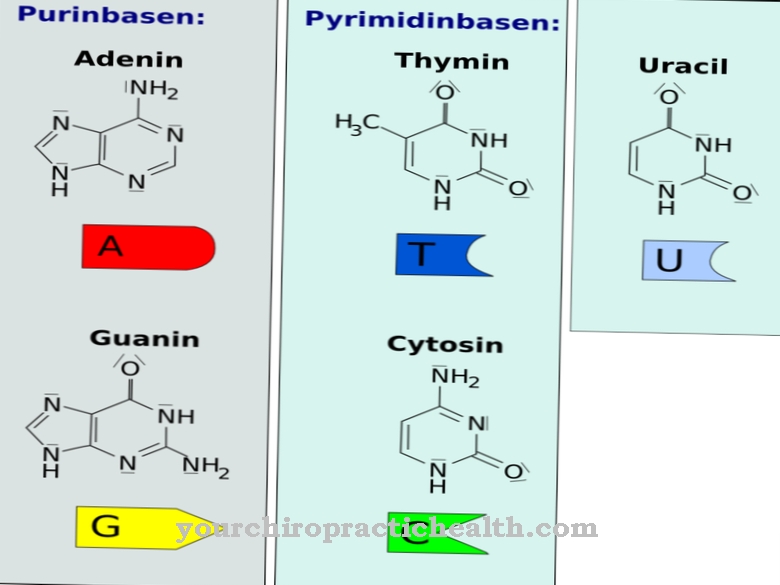
Hydroxylysine est un acide aminé protéinogène non classique. Il est incorporé dans la protéine correspondante sous forme de lysine et hydrolysé en hydroxylysine dans le polypeptide à l'aide d'une enzyme. C'est l'un des principaux composants des protéines de collagène dans le tissu conjonctif.
Qu'est-ce que l'hydroxylysine?
L'hydroxylysine est un acide aminé protéinogène qui est d'abord incorporé dans une protéine sous forme de lysine. C'est donc un acide aminé protéinogène non canonique. Le terme «canonique» signifie classique.
Il n'y a donc pas de codon pour cet acide aminé. L'hydroxylysine se trouve principalement dans le collagène du tissu conjonctif et dans les glycoprotéines. Là, la lysine est convertie en hydroxylysine via des processus enzymatiques. Seule une partie de la lysine est convertie en hydroxylysine. Les propriétés des collagènes respectifs dépendent de la quantité de résidus lysine et proline hydrolysés.
L'hydroxylysine peut être isolée sous forme libre sous forme de chlorhydrate. Le chlorhydrate d'hydroxylysine est une poudre beige avec un point de fusion de 225 à 230 degrés. C'est un acide aminé basique qui fait également réagir les protéines contenant de l'hydroxylysine de manière basique. L'hydroxylysine a été découverte par le biochimiste américain et co-fondateur de "Clinical Chemistry" Donald Van Slyke (1883-1971).
Fonction, effet et tâches
L'hydroxylysine est d'une grande importance pour la structure du tissu conjonctif. Les glycoprotéines contiennent également de l'hydroxylysine afin de former des composés glycosidiques de la protéine avec des résidus de sucre sur le résidu hydroxyle.
Dans le collagène, il est responsable de la réticulation des molécules de protéines individuelles. Avec l'hydroxylproline, la forme hydrolysée de la proline, elle joue également un rôle dans la construction des structures tertiaires et quaternaires du collagène. L'hydroxylation de la lysine est catalysée par l'enzyme lysyl hydroxylase avec la participation des cofacteurs ions fer et acide ascorbique (vitamine C). Le schéma de distribution des résidus de lysine hydroxylés dans le collagène n'est ni particulièrement rigide ni flexible. Il y a toujours des modèles récurrents.
Cependant, il existe également des zones entières dans la protéine qui ne contiennent aucun résidu de lysine hydroxylée. Alors que l'hydroxyproline est responsable de la structure hélicoïdale du collagène par la liaison de trois chaînes protéiques, des réticulations entre les diverses molécules protéiques sont formées via les groupes hydroxyle de l'hydroxylysine. De plus, ces groupes moléculaires servent également de site de liaison pour une liaison glycosidique avec un sucre. Globalement, cela garantit la solidité du tissu conjonctif.
S'il y a un manque d'hydroxylysine dans les protéines, cela ne peut pas être corrigé par un apport supplémentaire de l'acide aminé. Il n'y a pas de codon pour l'hydroxylysine libre, de sorte qu'elle ne peut pas être incorporée dans la protéine correspondante. L'intérêt des compléments alimentaires avec ajout d'hydroxylysine est donc très discutable. Par conséquent, la carence doit être due à une hydroxylation insuffisante de la lysine.
Éducation, occurrence, propriétés et valeurs optimales
L'hydroxylysine se trouve uniquement dans le collagène humain et animal. Il existe également des glycoprotéines qui contiennent également de l'hydroxylysine. Cela comprend l'adiponectine. L'adiponectine est une hormone produite dans le tissu adipeux et qui a une influence décisive sur l'efficacité de l'insuline. L'hydroxylysine a également été détectée dans certaines bactéries, telles que Staphylococcus aureus.
La distribution de la lysine hydroxylée n'est pas uniforme dans le collagène. Il y a des endroits où on le trouve presque toujours. Dans d'autres régions, l'hydroxylysine n'est presque jamais trouvée. Cette distribution inégale détermine la structure du collagène. Dans la structure à triple hélice du collagène, l'hydroxylysine est toujours située en position Y de la séquence répétitive Gly-X-Y. Dans les régions courtes avec une structure non hélicoïdale, l'hydroxylysine se produit également à d'autres endroits.
Maladies et troubles
Le tissu conjonctif est absolument dépendant de la présence d'hydroxylysine. Le collagène ne peut être stable et ferme que si les liaisons croisées entre les molécules de protéines fonctionnent. Une carence en hydroxylysine entraîne une faiblesse du tissu conjonctif.
S'il n'est présent qu'en quantités extrêmement faibles ou pas du tout, l'organisme correspondant ne serait pas viable. Le tissu conjonctif ne pouvait plus remplir sa tâche de tissu limitant et de soutien des organes. En fait, il existe des maladies qui peuvent être attribuées à un manque d'hydroxylysine. Étant donné que cet acide aminé est initialement incorporé sous forme de lysine lors de la synthèse des protéines, il ne peut s'agir d'une carence primaire. L'hydroxylysine est formée à partir de la lysine dans la protéine de collagène à l'aide de lysyl hydroxylases. Une carence en hydroxylysine ne peut résulter que d'un défaut de cette enzyme ou de sa fonction insuffisante.
Il existe un groupe de faiblesses congénitales hétérogènes du tissu conjonctif connu sous le nom de syndrome d'Ehlers-Danlos. Un certain nombre de mutations peuvent être responsables de ce tableau clinique. Entre autres, la lysyl hydroxylase peut également être défectueuse, de sorte que trop peu de lysine est hydroxylée. Le syndrome d'Ehlers-Danlos se manifeste par une extensibilité excessive de la peau et une surmobilité des articulations. Les organes internes, les vaisseaux sanguins, les tendons, les ligaments et les muscles sont également affectés. Le pronostic dépend de la gravité du défaut. Si les navires sont impliqués, une trajectoire défavorable est à prévoir. L'échec complet de l'enzyme lysyl hydroxylase est incompatible avec la vie et n'est donc pas observé.
Mais même avec une enzyme intacte, le tissu conjonctif peut être faible en raison de sa faible activité. La lysyl hydroxylase nécessite des ions fer et de l'acide ascorbique (vitamine C) comme cofacteurs. Si, par exemple, la vitamine C manque, ce que l'on appelle le scorbut se produit. Le scorbut est une maladie acquise du tissu conjonctif causée par un manque de groupes hydroxyle sur les résidus proline et lysine du collagène. La cause est la faible activité de la proline hydroxylase et de la lysine hydroxylase due au déficit en acide ascorbique.




.jpg)
.jpg)




.jpg)


.jpg)