Lysyl hydroxylases représentent un groupe d'enzymes responsables de l'hydroxylation des résidus de lysine dans les protéines. Ils contribuent donc principalement à la structure du tissu conjonctif. Les troubles de la fonction des lysyl hydroxylases se manifestent par des maladies telles que le scorbut ou le syndrome héréditaire d'Ehlers-Danlos.
Que sont les lysyl hydroxylases?
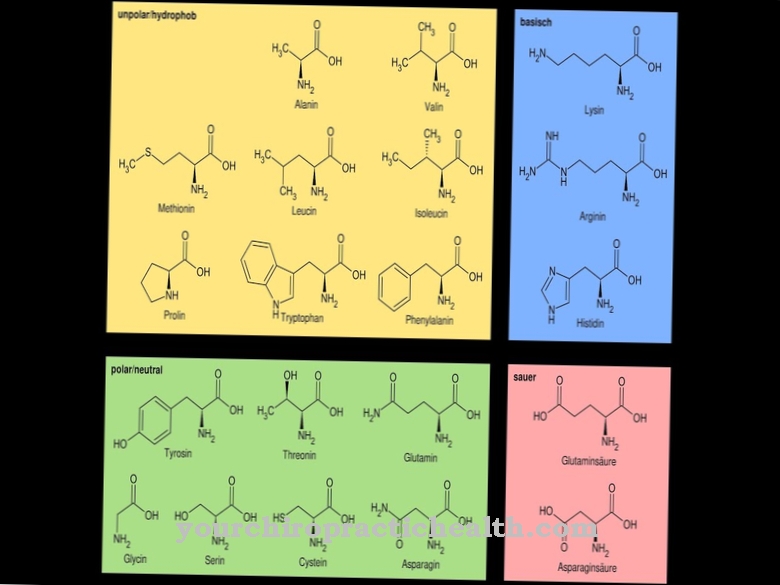
Les lysyl hydroxylases sont des enzymes dont le travail consiste à catalyser la modification post-traductionnelle de l'acide aminé lysine en incorporant un groupe hydroxyle dans l'hydroxyl lysine. Cela renforce le tissu conjonctif car ses chaînes protéiques ont la possibilité de se mettre en réseau via les groupes hydroxyle.
La lysyl hydroxylase humaine est constituée de 727 acides aminés. Les lysyl hydroxylases appartiennent également au groupe des hydroxylases, c'est-à-dire des enzymes qui catalysent généralement l'incorporation de groupes hydroxyle dans les molécules. En plus des lysyl hydroxylases, les hydroxylases ou oxydoréductases comprennent également les prolyl hydroxylases, la phénylalanine hydroxylase, la tyrosine hydroxylase ou la tryptophane hydroxylase. En particulier avec les prolyl hydroxylases, les lysyl hydroxylases jouent un rôle important dans la fonction du tissu conjonctif. Les deux groupes d'enzymes ont besoin de la coenzyme vitamine C pour leur fonction.
Fonction, effet et tâches
La fonction des lysyl hydroxylases consiste exclusivement à catalyser l'incorporation de groupements hydroxyles dans les résidus lysine au sein d'une protéine. Au cours d'une modification post-traductionnelle, l'acide aminé hydroxylamine est formé à partir de la lysine.
Bien que l'hydroxylamine soit également libre, elle ne peut pas être incorporée aux protéines sous cette forme. La modification post-traductionnelle signifie donc la conversion ultérieure de cet acide aminé après la formation de la protéine. Lorsqu'un atome d'hydrogène est échangé contre le groupe hydroxyle, un groupe fonctionnel qui peut effectuer des fonctions de pontage est intégré à la protéine à ce stade. Avec l'aide du groupe hydroxyle, différentes chaînes de protéines peuvent se lier. De plus, les molécules de sucre peuvent se lier à ce groupe fonctionnel. Les deux réactions sont très importantes, entre autres, dans le développement du tissu conjonctif.
Le tissu conjonctif renferme l'organisme et les organes internes. Il doit être ferme et tendu afin de pouvoir différencier les différents organes fonctionnellement. Ceci est assuré par les protéines du tissu conjonctif, qui contiennent un pourcentage élevé d'acides aminés lysine et proline.A cet effet, les deux acides aminés sont ensuite partiellement modifiés après leur incorporation dans la protéine par ajout d'un groupe hydroxyle. Comme déjà mentionné, avec la proline, cette réaction est catalysée par les prolyl hydroxylases et avec la lysine par les lysyl hydroxylases. Après la formation des protéines, ces réactions de modification créent un réseau de chaînes protéiques qui représentent le tissu conjonctif serré.
Sans la fonction des deux enzymes, le développement d'un tissu conjonctif fonctionnel ne serait pas du tout possible. Cependant, les deux enzymes ne fonctionnent qu'avec l'aide de la coenzyme acide ascorbique, c'est-à-dire de la vitamine C.Avec des enzymes structurellement modifiées par mutation ou par manque de vitamine C, cela peut entraîner des perturbations de la structure du tissu conjonctif et donc des maladies graves.
Éducation, occurrence, propriétés et valeurs optimales
Le gène PLOD1 est responsable du codage de la lysyl hydroxylase humaine. Le nom PLOD1 est dérivé du nom de la lysyl hydroxylase "procollagène lysine, 2-oxoglutarate-5-dioxygénase 1". Ce gène est situé sur le chromosome 1. Du nouveau tissu conjonctif étant constamment produit, il existe également un besoin permanent de production de lysyl hydroxylases. Une mutation de ce gène peut donc avoir des conséquences très graves sur la santé de l'organisme.
Maladies et troubles
Les perturbations de la fonction des lysyl hydroxylases jouent un rôle particulièrement important dans le scorbut et le syndrome d'Ehlers-Danlos. Le scorbut est connu comme une ancienne maladie de la mer, causée par un manque de vitamine C. La vitamine C, également connue sous le nom d'acide ascorbique, fonctionne comme une coenzyme des lysyl hydroxylases et des prolyl hydroxylases. S'il manque, les acides aminés lysine et proline dans la protéine du tissu conjonctif ne peuvent plus être hydroxylés.
Puisqu'il y a une accumulation et une dégradation constantes des protéines du tissu conjonctif, les chaînes protéiques sont de moins en moins capables de se mettre en réseau pendant la période de carence en vitamines. Le tissu conjonctif se détend et ne peut plus remplir correctement sa fonction. Divers symptômes se manifestent, notamment l'épuisement général, la susceptibilité aux infections, le saignement des gencives, la perte de dents, une mauvaise cicatrisation des plaies, de graves problèmes de peau, une fonte musculaire et de nombreux autres troubles de la santé. Le scorbut peut finalement entraîner la mort d'une insuffisance cardiaque générale ou d'infections graves. Les anciens marins étaient particulièrement touchés car ils ne pouvaient pas obtenir suffisamment de vitamine C lors des longs voyages en mer.
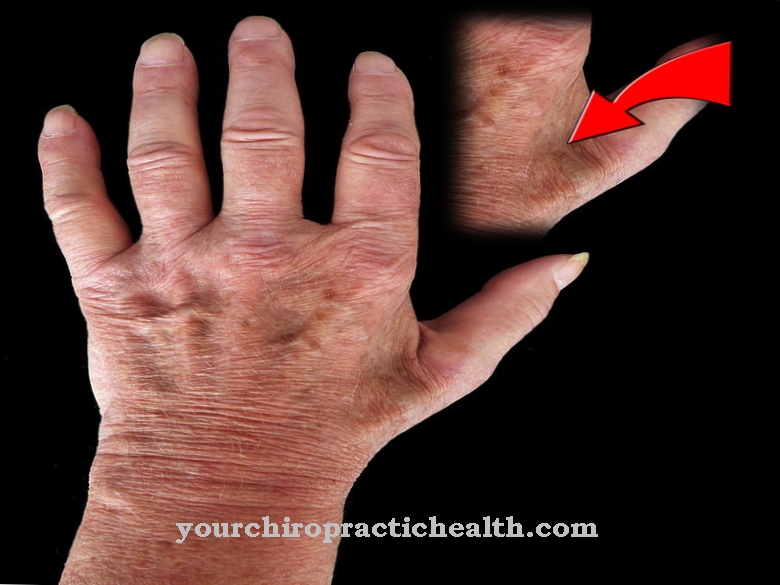
Il a été démontré que la maladie guérit immédiatement lorsque certains aliments comme la choucroute sont administrés. Il n'a été reconnu que plus tard que la cause de la maladie était une carence en vitamine C. L'épidémie de scorbut, maladie des gens de mer, a ensuite été évitée en nourrissant les gens de mer avec de la choucroute. Une autre maladie, qui ne peut être que partiellement attribuée à un défaut de la lysyl hydroxylase humaine, est le syndrome d'Ehlers-Danlos. Le syndrome d'Ehlers-Danlos est un terme collectif désignant diverses maladies héréditaires du tissu conjonctif ayant différentes causes. Ce syndrome est caractérisé par une faiblesse sévère du tissu conjonctif.
La peau est trop extensible et les articulations sont surmouvables. Une lysyl hydroxylase génétiquement modifiée déclenche le syndrome d'Ehlers-Danlos de type VI. Un gène muté appelé PLOD1, situé sur le chromosome 1, en est responsable. L'enzyme défectueuse formée à partir de celle-ci n'est plus pleinement fonctionnelle et ne peut catalyser que de manière insuffisante les réactions d'hydroxylation sur la lysine. Un tissu conjonctif faible se développe avec les symptômes connus ainsi qu'une atteinte supplémentaire des yeux et des organes internes. Le syndrome d'Ehlers-Danlos de type VI peut être hérité comme un trait autosomique récessif.





.jpg)