Desmosine est un acide aminé protéinogène. Avec d'autres acides aminés, il forme la fibre et l'élastine de protéine structurelle. Avec des mutations dans le gène ELN, la structure de l'élastine est perturbée.
Qu'est-ce que la desmosine?
Les acides aminés sont une partie importante de l'organisme humain. Ils appartiennent à une classe de composés organiques formés d'au moins un groupe carboxy et un groupe amino. Les acides aminés sont donc à la fois des acides carboxyliques et des amines.
En fonction de leur position par rapport au groupe carboxy, les acides aminés peuvent être attribués à différents groupes. Les acides aminés avec un groupe carboxy terminal sont appelés géminés ou α et comptent parmi les α-aminoacides. Ces acides aminés sont des éléments de protéines. Le corps humain possède plus de 20 acides aminés protéinogènes et 400 acides aminés non protéinogènes. Les acides aminés D constituent un groupe spécial. L'un des plus de 20 acides aminés protéinogènes est la desmosine, qui, avec l'isodesmosine de construction similaire, forme l'élastine, une protéine fibreuse.
L'élastine et sa tropoélastine, précurseur soluble, font partie des protéines structurales et contribuent à la mise en forme et à la rétention des structures anatomiques. L'élastine joue un rôle particulier dans la capacité des gros vaisseaux sanguins à s'étirer, par exemple l'aorte.
Fonction, effet et tâches
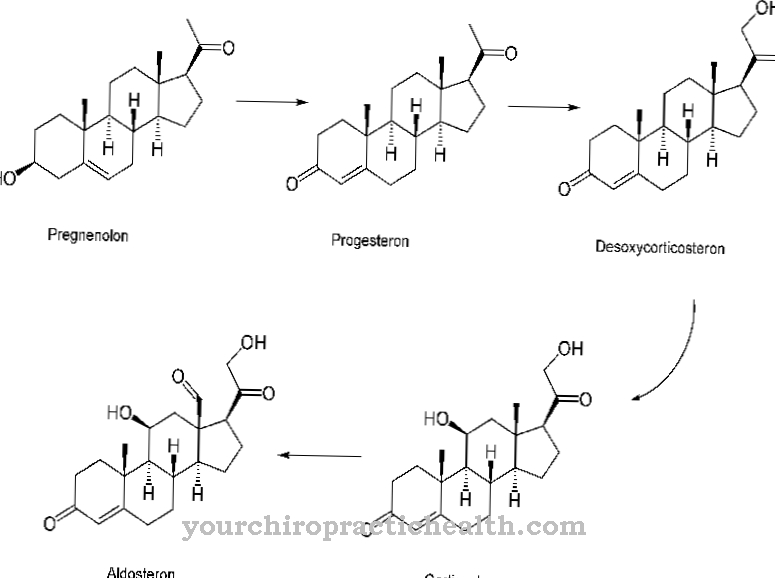
La desmosine est formellement un quadruple acide aminé. Il a un anneau de pyridinium au centre. La pyridine est un composé chimique de formule empirique C5H5N, qui peut être attribué aux systèmes parents hétérocycliques et forme l'azine la plus simple sous la forme d'un cycle à six chaînons avec un atome d'azote et cinq atomes de carbone.
Grâce à son anneau central pyridinium, la desmosine peut mettre en réseau les brins de protéines individuels dans l'élastine, protéine de fibre. La composition de l'élastine est similaire à celle du collagène. Au lieu de l'hydroxylysine, cependant, l'élastine contient une proportion significative de valine. Les résidus de lysine sont oxydés en allysine par l'enzyme lysyl oxydase. Trois allysines et une lysine forment à leur tour une desmosine sous la forme d'un anneau. Cette forme joue un rôle important dans l'élasticité d'une molécule d'élastine entière.
En tant que réseau protéique, l'élastine se compose d'unités liées à la desmosine et est élastiquement extensible. Les poumons ainsi que la peau et les vaisseaux sanguins dépendent de l'élastine et de sa composante desmosine, car c'est la seule manière d'obtenir leur élasticité considérable. La desmosine émet une fluorescence bleue sous la lumière UV et donne à l'élastine sa couleur jaune, son insolubilité dans l'eau, sa stabilité thermique et sa résistance aux alcalis et protéases.
Éducation, occurrence, propriétés et valeurs optimales
La formation de la desmosine est également connue sous le nom de biosynthèse de la desmosine. Au cours de cette biosynthèse, les groupes amino terminaux des unités L-lysine sont convertis en ω-aldéhydes par l'enzyme lysyl oxydase par oxydation.
La lysyl oxydase est une protéine lysine 6 oxydase et correspond donc à une enzyme qui se produit dans l'espace extracellulaire du tissu conjonctif. Dans la réticulation de l'élastine et du collagène, il sert de catalyseur et de stabilisateur mécanique pour les protéines. Lors de la biosynthèse de la desmosine, la lysyl oxydase convertit la lysine en allysine. Ce processus se déroule dans la matrice extracellulaire et stabilise les réticulations entre le collagène et l'élastine.Du point de vue chimique, la réaction correspond à une désamination oxydative pour former l'aldéhyde. L'allysine forme soit de l'allysinaldol soit de la desmosine avec des résidus aldéhyde de molécules de tropélastine voisines par une condensation d'aldol.
La lysine restante forme une base de Schiff via son groupe amino et crée de l'isodesmosine. Outre les vaisseaux sanguins, les poumons et la peau, toutes les microfibrilles en particulier transportent de la desmosine. Ce sont les plus petites fibres de tissu collagène, réticulaire et élastique.
Maladies et troubles
La formation d'élastine à partir de composants tels que la desmosine est perturbée dans diverses maladies. Ces maladies comprennent principalement des mutations dans le gène ELN. Les plus importants sont la dermatochalase, le syndrome de Williams-Beuren et la sténose aortique congénitale sous-valvulaire. La dermatochalase est un groupe de modifications du tissu conjonctif avec accumulation familiale.
La caractéristique de ce groupe est la peau affaissée, moins élastique et ridée sur diverses parties du corps. Le gène ELN code pour l'élastine et peut provoquer de tels symptômes par mutation. Le syndrome de Williams-Beuren est plutôt rare par rapport à cela, n'affectant qu'un nouveau-né sur 20 000. La maladie est causée par un défaut du chromosome sept. Le locus du gène est 7q11.23. En raison d'un défaut à ce stade, la personne affectée n'a pas le gène de l'élastine et les gènes voisins. La suppression du gène de l'élastine provoque une dysmorphie faciale et des troubles de la structure interne des organes. Des anomalies cardiaques telles qu'une sténose aortique supravalvulaire et des malformations rénales telles que le rein en fer à cheval ou une sténose vasculaire rénale peuvent en résulter. De plus, il existe souvent un handicap cognitif.
Les capacités mentales des personnes touchées sont inférieures à la moyenne. Malgré l'expressivité verbale, ils forment principalement des phrases avec peu de contenu. Ils commencent à lire à un âge extrêmement précoce, ce qui surestime souvent leurs capacités mentales. Outre leur hyperlexie, leur hauteur parfaite conduit souvent à des surestimations. En tant que mutation de l'élastine, la sténose aortique congénitale sous-valvulaire correspond à son tour à une malformation cardiaque associée à un rétrécissement de l'artère principale. La sténose supravalvulaire se situe sur la valve aortique au début de l'aorte.
Cette forme de malformation cardiaque est souvent caractérisée par des constrictions en forme de sablier qui se situent au-dessus de la sortie des vaisseaux coronaires. La partie ascendante de l'aorte peut également être rétrécie. Cette forme de sténose aortique survient particulièrement souvent dans le contexte du syndrome de Williams-Beuren dont nous venons de parler. Cette malformation cardiaque a déjà été observée quelle que soit la maladie. Dans ce cas, cependant, il ne doit pas nécessairement être lié à une mutation du gène de l'élastine.



.jpg)









.jpg)
.jpg)

.jpg)