le Synthèse d'hémoglobine se compose de la synthèse de l'hème et de la synthèse de la globine. Enfin, le groupe hème prothétique, chacun avec quatre globines, est lié à l'hémoglobine complexe protéique contenant du fer. Des perturbations de la synthèse de l'hème et de la synthèse de la globine peuvent entraîner de graves problèmes de santé.
Qu'est-ce que la synthèse de l'hémoglobine?

Afin de comprendre la synthèse de l'hémoglobine, la connaissance de la structure de l'hémoglobine est d'abord nécessaire. L'hémoglobine est un complexe protéique contenant du fer, qui se compose de quatre sous-unités de globine, chacune avec un groupe hème prothétique.
Dans l'hémoglobine humaine adulte, il existe deux alpha globines identiques ainsi que deux bêta-globines identiques en tant que sous-unités. Chacune de ces sous-unités est liée à un groupe hème prothétique, qui consiste en un complexe de porphyrine fer (II). Ainsi, un complexe d'hémoglobine contient quatre groupes hème.
Selon l'environnement chimique, chaque groupe hème peut lier une molécule d'oxygène à l'ion ferreux de manière complexe. En fonction du nombre de groupes hèmes chargés en oxygène, on parle d'oxyhémoglobine (riche en oxygène) ou de désoxyhémoglobine (pauvre en oxygène).
L'ion ferreux est situé au milieu de l'anneau de porphyrine. Sur le côté, il y a une liaison complexe avec le résidu histidine de la globine. D'autre part, en fonction de l'état énergétique de l'ion fer, une molécule d'oxygène peut être liée dans un complexe. L'état énergétique est influencé par les conditions physiques et chimiques externes en raison des changements de conformation de la globine.
Fonction et tâche
La dernière étape de la synthèse de l'hémoglobine consiste à assembler le groupe hème prothétique avec les quatre unités de globine pour former un complexe protéique contenant du fer. Les composants individuels sont formés par des voies biosynthétiques indépendantes.
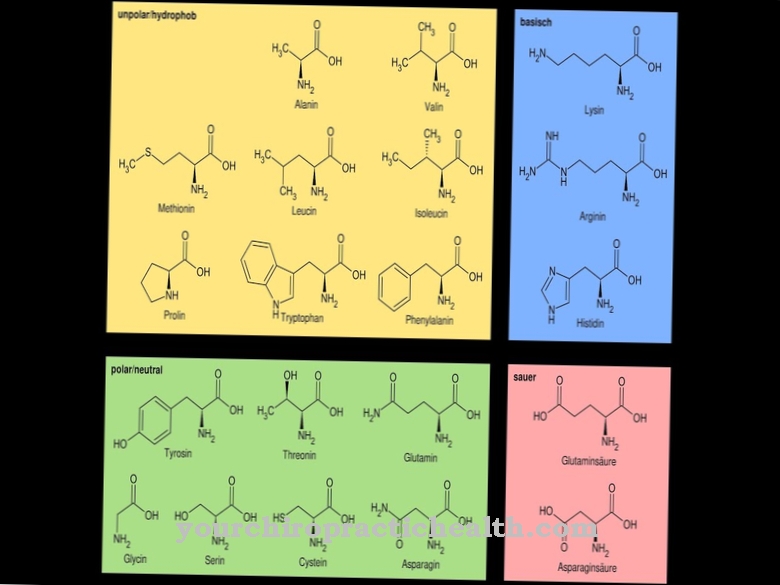
Les matières premières pour le cycle porphyrine du groupe hème sont les acides aminés glycine et succinyl-CoA. Succinyl-CoA est composé de coenzyme A et d'acide succinique. L'acide succinique est un produit intermédiaire dans la dégradation des corps cétoniques riches en énergie dans le cadre du métabolisme énergétique. À l'aide de l'enzyme delta-aminolévulinique acide synthase, l'acide delta-aminolévulinique est synthétisé à partir de succinyl-CoA et de glycine. Deux molécules d'acide delta-aminolévulinique se condensent avec l'élimination d'une molécule d'eau pour former le dérivé de pyrrole porphobilinogène. Avec l'élimination de l'ammoniac et à l'aide de l'enzyme uroporphyrinogène-I synthétase, quatre molécules de porphobiliogène réagissent pour former l'hydroxyméthylbilane. Celui-ci est transformé en uroporphyrinogène III avec formation d'un cycle.
La protoporphyrine est produite par décarboxylation enzymatique et déshydratation dans les mitochondries. Avec l'enzyme ferrochélatase, un ion fer (II) est incorporé dans cette molécule avec formation d'hème. Dans le cytosol de la cellule, l'hème est lié à la protéine globine pour former l'hémoglobine complexe protéique contenant du fer.
La synthèse des globines individuelles a lieu via la biosynthèse normale des protéines. Comme déjà mentionné, le complexe d'hémoglobine adulte contient deux sous-unités identiques d'alpha et de bêta-globines. En raison de sa structure complexe, l'hémoglobine finie a développé la capacité de transporter l'oxygène et de le fournir à toutes les cellules de l'organisme.
Cependant, la liaison du fer central à l'oxygène n'est pas très serrée et peut être influencée très facilement par des facteurs chimiques et physiques externes. Cela permet à l'hémoglobine d'absorber et de libérer rapidement l'oxygène. La teneur en oxygène de l'hémoglobine dépend, entre autres, des facteurs pH, dioxyde de carbone ou pression partielle ou température d'oxygène. Ces variables influentes modifient, par exemple, la conformité des globines, de sorte que la liaison oxygène peut être renforcée ou affaiblie par de légers changements dans les conditions énergétiques et stériques.
Avec une valeur de pH faible et une pression partielle de dioxyde de carbone élevée, la liaison oxygène à l'ion fer (II) est affaiblie et ainsi la libération d'oxygène est favorisée. Exactement dans ces conditions, un renouvellement métabolique plus important a lieu, ce qui entraîne également une demande accrue en oxygène. Le système de transport de l'oxygène est donc parfaitement coordonné avec les besoins physiques via la fonction d'hémoglobine.
Maladies et affections
Les perturbations de la synthèse de l'hémoglobine peuvent entraîner diverses maladies. Il existe un certain nombre de maladies génétiques basées sur la perturbation de la synthèse de l'hème. Dans le processus, les précurseurs de l'hème s'accumulent dans le corps, ce qui conduit entre autres à une extrême sensibilité à la lumière. Dans ces soi-disant porphyries, les porphyrines sont stockées dans les vaisseaux sanguins ou même le foie. Lorsqu'elles sont exposées à la lumière, certaines formes de porphyrie stockent plus d'énergie de rayonnement. Lorsque l'énergie est libérée, des radicaux oxygène sont créés qui attaquent et détruisent les tissus exposés. Cela entraîne de fortes démangeaisons et une douleur brûlante.
Il existe sept formes de porphyre. La construction de l'hème est un processus en huit étapes dans lequel sept enzymes sont impliquées. Si une enzyme ne fonctionne que de manière inadéquate, le précurseur respectif est stocké à ce stade de la synthèse de l'hème. Sur la base des symptômes, les porphyries sont divisées en deux groupes principaux. Les porphyries dites cutanées sont caractérisées par la sensibilité douloureuse de la peau à la lumière.Dans les porphyries hépatiques, l'atteinte hépatique prédomine avec des douleurs abdominales sévères, des nausées et des vomissements. Dans de nombreux cas, cependant, il existe un chevauchement entre les deux complexes de symptômes.
Les porphyries montrent souvent une évolution intermittente avec des crises aiguës. Selon le type de porphyrie, celles-ci se manifestent par des réactions cutanées soudainement douloureuses, des douleurs abdominales de type colique, des nausées / vomissements, une coloration rouge des urines, des convulsions, des déficits neurologiques ou même des psychoses.
D'autres troubles de la synthèse de l'hémoglobine sont liés à la synthèse défectueuse des molécules de globine par mutations dans les gènes correspondants. Des exemples sont la soi-disant anémie falciforme ou thalassémie. Dans la drépanocytose, la protéine de la sous-unité bêta globine est génétiquement modifiée. En position six de cette protéine, l'acide aminé acide glutamique a été remplacé par la valine. En cas de manque d'oxygène, l'hémoglobine concernée prend la forme d'une faucille, s'agglutine et obstrue les petits vaisseaux sanguins. Il en résulte des troubles circulatoires potentiellement mortels. Les thalassémies sont un groupe de différentes malformations de l'hémoglobine qui conduisent à une réduction de la formation de la chaîne de globine de l'alpha ou de la bêta globine. L'anémie sévère est le symptôme le plus important.







.jpg)