Déshydrogénases sont des enzymes impliquées dans les processus d'oxydation. Ils se produisent dans différentes variantes dans le corps humain et, par exemple, catalysent la dégradation de l'alcool dans le foie.
Que sont les déshydrogénases?
Les déshydrogénases sont des enzymes spécialisées. Les biocatalyseurs accélèrent l'oxydation naturelle des substrats. Une substance qui s'oxyde perd des électrons. Dans les réactions biologiques, les déshydrogénases séparent les anions hydrogène d'un substrat. Les anions sont des particules chargées négativement.
Dans ce cas, un atome d'hydrogène accepte un électron et reçoit ainsi une charge électrique négative. La réaction proprement dite a lieu au centre actif de l'enzyme. Lorsque la déshydrogénase clive l'anion hydrogène d'un substrat, les cofacteurs absorbent les électrons et l'hydrogène. Les cofacteurs sont des molécules qui jouent un rôle d'aide dans les processus enzymatiques, mais qui ne sont pas impliquées dans le clivage lui-même. Les cofacteurs des déshydrogénases comprennent le nicotinamide adénine dinucléotide (NAD +) et la flavine adénine dinucléotide (FAD).
Contrairement aux déshydrogénases, les déshydratases séparent des molécules d'eau entières de leur substrat. Les déshydrogénases peuvent également provoquer la contre-réaction et contribuer à la réduction au lieu de l'oxydation. Pendant la réduction, une particule accepte les électrons au lieu de les abandonner. La biologie attribue des déshydrogénases aux oxydes réductases. Ces types d'enzymes existent dans chaque organisme vivant.
Fonction, effet et tâches
Les déshydrogénases sont un groupe composé de nombreuses enzymes spécialisées. Les enzymes individuelles ont différentes tâches dans le corps humain. La biologie divise les diverses déshydrogénases en sous-groupes supplémentaires.
Les aldéhyde déshydrogénases (ALDH), par exemple, forment un groupe de déshydrogénases qui se trouvent principalement dans le foie. En règle générale, un ALDH n'est responsable que d'un certain substrat et ne peut pas contribuer à l'oxydation d'autres substrats. Par exemple, ALDH1A1, -1A2 et -1A3 traitent la rétine, qui se trouve dans la vitamine A. Il existe cependant des exceptions à cette règle: ALDH2, par exemple, peut fonctionner avec différents substrats et n'est pas limité à une seule substance.
Dans le foie, les déshydrogénases décomposent l'alcool, par exemple l'éthanol. Ils aident à nettoyer le sang, qui est l'une des tâches les plus importantes du foie. La molécule d'éthanol se fixe d'abord au centre actif d'une alcool hydrogénase (ADH). Avec l'aide de l'enzyme, l'éthanol s'oxyde en séparant l'atome d'hydrogène chargé négativement et en le donnant à son cofacteur NAD +: ADH convertit l'éthanol en acétaldéhyde de cette manière. L'acétaldéhyde, ou éthanal, est toxique et cause un certain nombre de problèmes de santé.
Les aliments ne contiennent normalement qu'une petite quantité d'éthanol, que le corps peut convertir rapidement. Par conséquent, les quantités d'éthanal ne sont que faibles. L'acétaldéhyde est à son tour le substrat de l'ALDH. L'ALDH catalyse la conversion de l'acétaldéhyde en acide acétique avant que l'acide acétique puisse être davantage divisé et décomposé en eau et en dioxyde de carbone. Sous cette forme, les molécules sont totalement inoffensives.
Éducation, occurrence, propriétés et valeurs optimales
Les déshydrogénases sont principalement situées dans les parties liquides du plasma cellulaire ou dans les mitochondries. Le corps des femmes produit moins d'ADH que celui des hommes. Cela contribue au fait que les femmes sont en moyenne plus sensibles à l'alcool.
Les valeurs exactes des différentes déshydrogénases varient non seulement entre les différents groupes d'enzymes, mais également entre les différents individus et groupes ethniques. En Asie de l'Est et parmi les peuples autochtones d'Amérique et d'Australie, les niveaux d'ADH sont en moyenne inférieurs à ceux, par exemple, des Européens. Le génome humain possède 19 gènes connus qui déterminent l'ALDH. Ces gènes sont sur le douzième chromosome. Ils déterminent quel ordre les acides aminés prennent dans les chaînes protéiques.
Les propriétés des structures protéiques résultent de cette séquence. La forme des déshydrogénases et donc leur fonction dépend également de la séquence des acides aminés lors de la synthèse. Par exemple, ALDH2 se compose de 500 acides aminés. En règle générale, les cellules synthétisent des déshydrogénases, dont elles ont également besoin plus tard; Cela signifie qu'il n'est pas nécessaire de transporter les substances.
Maladies et troubles
Lorsque l'alcool est décomposé dans le corps humain, l'acétaldéhyde se forme comme étape intermédiaire. La substance est toxique; l'enzyme ALDH doit donc le convertir le plus rapidement possible en acide acétique. Cependant, avec de plus grandes quantités d'alcool, cela ne fonctionne généralement pas complètement. Par conséquent, la gueule de bois persiste quelques heures après avoir consommé de l'alcool.
La médecine l'appelle également veisalgie. Les symptômes typiques sont des maux de tête, des malaises, des nausées dans l'estomac, des vomissements et une perte d'appétit. La capacité de concentration et de réaction est souvent limitée. La sensibilité des personnes à l'alcool dépend, entre autres, du nombre de déshydrogénases produites par les cellules hépatiques. Les déshydrogénases jouent également un rôle dans le développement ou le maintien de diverses maladies. La graisse aldéhyde déshydrogénase (FALDH), par exemple, joue un rôle central dans le développement du syndrome de Sjögren.
Les principaux symptômes du tableau clinique sont un retard mental et une paraplégie spastique progressive. La paraplégie spastique est une maladie neurodégénérative et se caractérise par une paralysie spastique des jambes. Le syndrome de Sjögren-Larsson signifie également que la couche cornée de la peau est plus prononcée et forme des flocons cutanés clairement visibles (ichtyose). En plus de ces trois symptômes cardinaux, les troubles de la rétine sont fréquents. La cause du syndrome réside dans les gènes qui codent pour la FALDH. En raison d'une mutation, le corps ne synthétise pas correctement le complexe enzymatique avec FALDH. En conséquence, la concentration d'alcools gras et d'aldéhydes gras dans le plasma sanguin augmente.

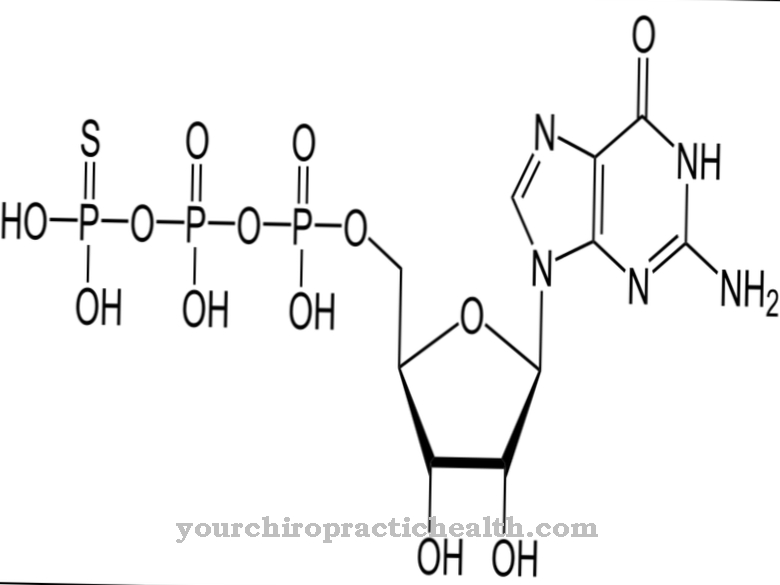












.jpg)