le Entéropeptidase est une enzyme de la muqueuse duodénale dont la fonction est d'activer les enzymes pancréatiques. Il se situe au début de toute une cascade d'activation d'enzymes digestives. Le dysfonctionnement de l'entéropeptidase entraîne une mauvaise digestion et une malabsorption des aliments dans l'intestin grêle.
Qu'est-ce qu'une entéropeptidase?
L'entéropeptidase est une enzyme de la muqueuse duodénale, qui active les enzymes digestives du pancréas en activant le trypsinogène en trypsine.
L'entéropeptidase est sécrétée dans la bordure en brosse de la muqueuse duodénale. Plus précisément, les glandes de liebekühn sont responsables de la sécrétion. Les glandes de Liebekühn sont des dépressions tubulaires dans le petit et le grand épithélium intestinal. Dans l'intestin grêle, ils sont situés entre les petites villosités intestinales. Les glandes, également appelées cryptes de Lieberkühn, sécrètent un grand nombre d'enzymes en plus de l'entéropeptidase. La sécrétion d'entéropeptidase est stimulée lorsque le chyme, qui a été pré-digéré dans l'estomac, pénètre dans le duodénum. L'enzyme seule n'affecte pas les composants alimentaires.
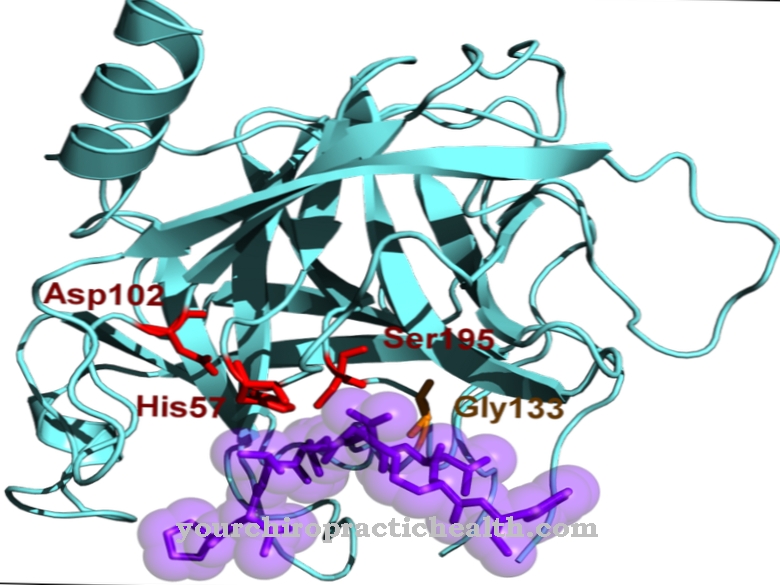
Seule l'activation de l'enzyme trypsine met en mouvement toute la cascade d'activation des enzymes digestives. L'entéropeptidase, comme la trypsine et les autres protéases du pancréas, est une sérine protéase. Le centre actif contient la triade catalytique d'acide aspartique, d'histidine et de sérine. En tant qu'endopeptidase, l'entéropeptidase ne clive les protéines qu'en certains points caractéristiques avec certains motifs de reconnaissance dans la séquence d'acides aminés. L'enzyme clive toujours au niveau du motif de reconnaissance Asp-Asp-Asp-Asp-Lys. Avec le trypsinogène, l'hexapeptide Val- (Asp) 4-Lys est clivé, la trypsine étant formée.
Fonction, effet et tâches
La fonction de l'entéropeptidase est d'activer les enzymes digestives du pancréas. Il ne lance que la première étape d'activation avec la conversion du trypsinogène en trypsine.
La trypsine est à son tour une sérine protéase qui clive les protéines sur la base du même motif de reconnaissance caractéristique. Il poursuit maintenant l'activation du trypsinogène lui-même. En même temps, il active d'autres enzymes pancréatiques à partir de leurs précurseurs respectifs tels que le chymotrypsinogène, la pro-élastase, la pro-carboxypeptidase, la pro-phospholipase et la pro-entéropeptidase. L'entéropeptidase est également initialement dans le formulaire inactif. Lorsque les aliments pénètrent dans le duodénum, en plus de la proenteropeptidase, la duodénase est également sécrétée, ce qui active la forme de l'entéropeptidase. Après le début de la cascade d'activation, la trypsine prend le relais de l'activation de toutes les enzymes pancréatiques, y compris la proentéropeptidase et le trypsinogène.
L'activation de la proentéropeptidase en entéropeptidase se fait encore plus efficacement par l'action de la trypsine que par la duodénase. La présence primaire des enzymes digestives sous leur forme inactive est extrêmement importante. L'action des protéases en particulier n'est pas spécifique. Toutes les protéines qui contiennent le motif de reconnaissance caractéristique dans la molécule sont clivées par hydrolyse. Si les enzymes étaient catalytiquement actives immédiatement, les propres protéines du corps seraient déjà digérées dans le pancréas et le canal pancréatique. En conséquence, le pancréas se dissoudrait. L'activation n'a lieu que dans le duodénum en dehors des glandes exocrines.
Les enzymes peuvent commencer ici à décomposer les composants alimentaires sans attaquer les propres tissus du corps. Pour éviter que les enzymes ne soient activées prématurément, un inhibiteur supplémentaire de la trypsine agit dans le canal du pancréas. Cependant, le rôle clé de la cascade digestive est joué par la trypsine. Une fois cette enzyme activée, l'activation de toutes les enzymes digestives, y compris l'entéropeptidase, ne peut pas être arrêtée.
Éducation, occurrence, propriétés et valeurs optimales
Comme toutes les sérine protéases, l'entéropeptidase a également un effet non spécifique et clive les protéines en utilisant un motif de reconnaissance caractéristique. L'entéropeptidase se compose d'une chaîne légère et d'une chaîne lourde liées par des ponts disulfure. Le domaine sérine protéase est situé sur la chaîne légère.
La chaîne lourde a une masse moléculaire de 82 à 140 kilodaltons, la masse moléculaire de la chaîne légère étant de 35 à 62 kilodaltons. La structure de la chaîne légère de l'entéropeptidase est similaire à celle des autres sérine protéases, la trypsine et la chymotrypsine. La chaîne lourde est liée à la membrane et influence la spécificité de l'enzyme. Il a été trouvé que la chaîne légère isolée a un effet similaire contre le motif de reconnaissance caractéristique - (Asp) 4-Lys-, mais un effet significativement plus faible contre le trypsinogène.
Maladies et troubles
L'entéropeptidase humaine est codée par le gène ENTK sur le chromosome 21. Une mutation de ce gène peut entraîner des maladies graves chez les enfants atteints.
L'enzyme ne peut plus activer les autres enzymes digestives. Les composants alimentaires ne sont plus dégradés et ne peuvent donc plus être absorbés par l'intestin grêle. Il s'agit avant tout d'une mauvaise digestion (dégradation insuffisante), qui conduit à une malabsorption des composants alimentaires. Le corps n'est plus suffisamment alimenté en nutriments. Un retard de croissance, un retard de croissance et des symptômes typiques de carence en protéines avec le développement d'un œdème se produisent. Dans le même temps, en plus des protéines, les glucides et les graisses sont mal absorbés. Étant donné que les composants alimentaires non digérés pénètrent dans le gros intestin et y sont décomposés par la fermentation et les bactéries putréfactives, des flatulences, des diarrhées et des douleurs abdominales se produisent également.
Jusqu'à présent, 15 cas de déficit congénital en entéropeptidase ont été décrits dans le monde. Cependant, les symptômes de la maladie sont beaucoup plus courants. Un déficit en entéropeptidase ne doit pas toujours être présent. Puisque la trypsine joue un rôle clé dans l'activation des enzymes digestives, un défaut ou une carence en trypsine entraîne également des symptômes similaires. Le traitement de ces maladies est le même dans les deux cas. Les enzymes sont administrées sous forme activée. Il y a certainement beaucoup plus de cas non diagnostiqués de déficit en entéropeptidase.
Si le diagnostic est certain, l'entéropeptidase peut également être remplacée. Un déficit en entéropeptidase est également déclenché secondairement par des maladies intestinales sévères.Les maladies telles que la maladie cœliaque, l'intestin grêle raccourci, le déficit en lactase ou autres doivent être clarifiées dans le diagnostic différentiel.












.jpg)
.jpg)

.jpg)