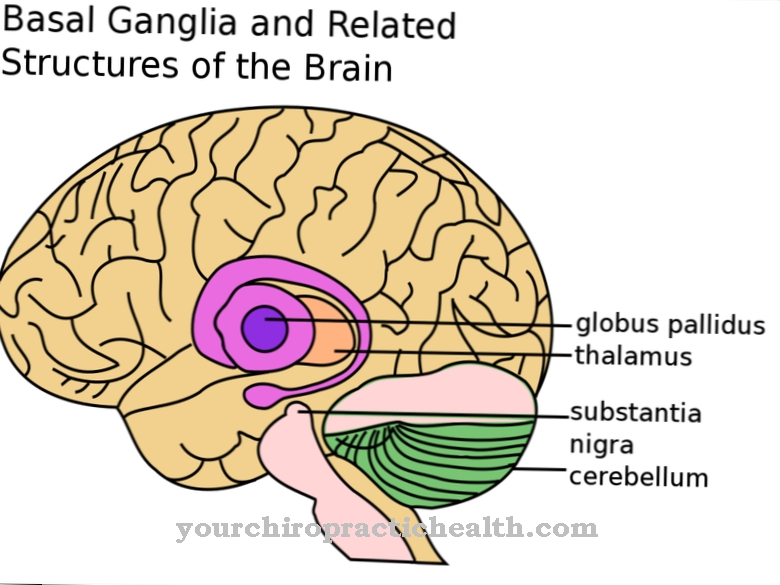
le Épissure représente un processus crucial lors de la transcription dans le noyau des eucaryotes, au cours duquel l'ARNm mature émerge du pré-ARNm. Les introns qui sont toujours contenus dans le pré-ARNm après la transcription sont éliminés et les exons restants sont combinés pour former l'ARNm fini.
Qu'est-ce que l'épissage

Le dogme central de la biologie moléculaire stipule que le flux d'informations génétiques a lieu de l'ADN porteur d'informations via l'ARN à la protéine. La première étape de l'expression génique est ce que l'on appelle la transcription. L'ARN est synthétisé en utilisant l'ADN comme matrice. L'ADN est le porteur de l'information génétique, qui y est stockée à l'aide d'un code composé des quatre bases adènes, thymine, guanine et cytosine. Le complexe protéine ARN polymérase lit la séquence de bases de l'ADN pendant la transcription et produit le «pré-ARN messager» correspondant (en abrégé pré-ARNm). Au lieu de la thymine, l'uracile est toujours incorporé.
Les gènes sont constitués d'exons et d'introns. Les exons sont les parties du génome qui codent réellement les informations génétiques. En revanche, les introns représentent des sections non codantes au sein d'un gène, les gènes stockés sur l'ADN sont traversés par de longues sections qui ne correspondent à aucun acide aminé dans la dernière protéine et ne contribuent pas à la traduction.
Un gène peut avoir jusqu'à 60 introns, avec des longueurs comprises entre 35 et 100 000 nucléotides. En moyenne, ces introns sont dix fois plus longs que les exons. Le pré-ARNm produit dans la première étape de transcription, également souvent appelé ARNm immature, contient encore à la fois des exons et des introns. C'est là que commence le processus d'épissage.
Les introns doivent être éliminés du pré-ARNm et les exons restants doivent être liés ensemble. Ce n'est qu'alors que l'ARNm mature peut quitter le noyau cellulaire et lancer la traduction.
L'épissage est principalement réalisé à l'aide du spliceosome (allemand: spliceosome). Celui-ci est composé de cinq snRNP (petites particules de ribonucléoprotéine nucléaire). Chacun de ces snRNP est constitué d'un snRNA et de protéines. Certaines autres protéines qui ne font pas partie des snRNP font également partie du spliceosome. Les spliceosomes sont divisés en spliceosomes majeurs et mineurs. Le spliceosome majeur traite plus de 95% de tous les introns humains, le spliceosome mineur gère principalement les introns ATAC.
Pour l'explication de l'épissage, Richard John Roberts et Phillip A. Sharp ont reçu le prix Nobel de médecine en 1993. Thomas R. Cech et Sidney Altman ont reçu le prix Nobel de chimie en 1989 pour leurs recherches sur l'épissage alternatif et l'effet catalytique de l'ARN.
Fonction et tâche
Pendant le processus d'épissage, le spliceosome est formé à nouveau à partir de ses parties individuelles. Chez les mammifères, le snRNP U1 se fixe d’abord sur le site d’épissage 5’ et initie la formation du spliceosome restant. Le snRNP U2 se lie au point de branchement de l'intron. Ensuite, lie également le tri-snRNP.
Le spliceosome catalyse la réaction d'épissage au moyen de deux transestérifications successives. Dans la première partie de la réaction, un atome d’oxygène du groupe 2’-OH d’une adénosine de la "séquence de points de ramification" (BPS) attaque un atome de phosphore d’une liaison phosphodiester dans le site d’épissage 5 '. Cela libère l'exon 5 'et fait circuler l'intron. L'atome d'oxygène du groupe 3'-OH maintenant libre de l'exon 5'-exon se lie maintenant au site d'épissage 3 ', moyennant quoi les deux exons sont connectés et l'intron est libéré. L'intron est amené dans une conformation simplifiée, appelée lariat, qui est ensuite décomposée.
Contrairement à cela, les épissosomes ne jouent pas de rôle dans l'auto-épissage. Ici, les introns sont exclus de la traduction par la structure secondaire de l'ARN lui-même. L'épissage enzymatique de l'ARNt (ARN de transfert) se produit chez les eucaryotes et les archées, mais pas chez les bactéries.
Le processus d'épissage doit se dérouler avec une extrême précision exactement à la limite exon-intron, car une déviation d'un seul nucléotide conduirait à un codage incorrect des acides aminés et donc à la formation de protéines complètement différentes.
L'épissage d'un pré-ARNm peut se révéler différemment en raison d'influences environnementales ou du type de tissu. Cela signifie que différentes protéines peuvent être formées à partir de la même séquence d'ADN et donc du même pré-ARNm. Ce processus est connu sous le nom d'épissage alternatif. Une cellule humaine contient environ 20 000 gènes, mais est capable de produire plusieurs centaines de milliers de protéines grâce à un épissage alternatif. Environ 30% de tous les gènes humains ont un épissage alternatif.
L'épissage a joué un rôle majeur dans l'évolution. Les exons codent souvent des domaines individuels de protéines, qui peuvent être combinés les uns avec les autres de différentes manières. Cela signifie qu'une grande variété de protéines avec des fonctions complètement différentes peut être produite à partir de quelques exons seulement. Ce processus est appelé mélange d'exons.
Maladies et affections
Certaines maladies héréditaires peuvent être étroitement liées à l'épissage. Les mutations des introns non codants n'entraînent généralement pas d'erreurs dans la formation des protéines. Cependant, si une mutation se produit dans une partie d'un intron qui est importante pour la régulation de l'épissage, cela peut conduire à un épissage défectueux du pré-ARNm. L'ARNm mature résultant code alors pour des protéines défectueuses ou, dans le pire des cas, nocives. C'est le cas, par exemple, de certains types de bêta-thalassémie, une anémie héréditaire. D'autres représentants de maladies qui se développent de cette manière sont, par exemple, le syndrome d'Ehlers-Danlos (EDS) de type II et l'atrophie musculaire spinale.





.jpg)
.jpg)




.jpg)


.jpg)