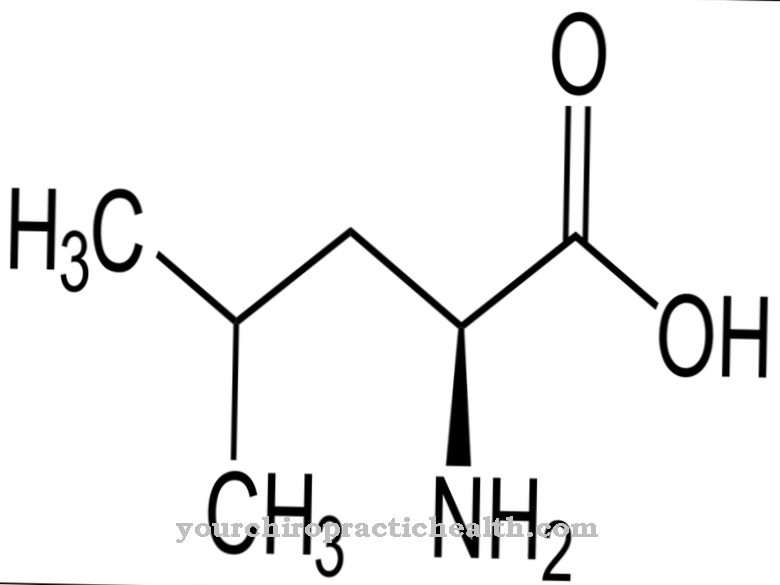
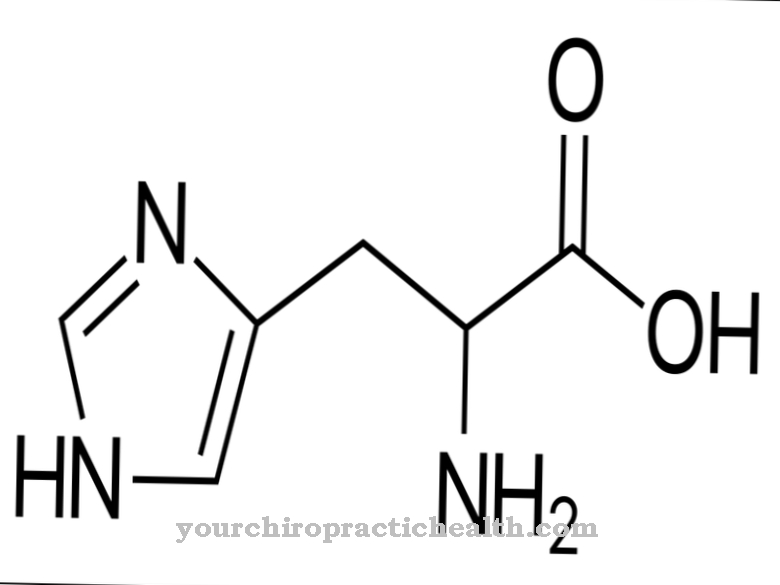
Méthionine est le seul acide aminé protéinogène contenant du soufre en plus de la cystéine. Dans la synthèse des protéines, la L-méthionine - sa forme naturelle et biochimiquement active - occupe une place particulière car elle représente toujours le premier acide aminé, la substance de départ à partir de laquelle une protéine est constituée. La L-méthionine est essentielle et sert principalement de fournisseur de groupes méthyle (-CH3) pour des hormones importantes telles que la choline, l'adrénaline, la créatine et bien d'autres.
Qu'est-ce que la méthionine?
La L-méthionine (M ou Met), la forme naturelle et bioactive de la méthionine, est un acide aminé protéinogène essentiel. Outre la cystéine, qui est à son tour synthétisée à partir de la méthionine, c'est le seul acide aminé soufré. La L-méthionine occupe une place particulière dans la synthèse des protéines car elle est toujours le premier acide aminé, l'acide aminé de départ, pour la structure de chaque protéine.
La méthionine est codée sur l'ARNm (ARN messager) par le triplet de bases nucléiques adénine-uracile-guanine (AUG), également connu sous le nom de codon de départ. Cela signifie que chaque ARNm commence par le triplet de démarrage AUG. Afin de démarrer la synthèse des protéines, l'ARNt (ARN de transport) doit d'abord fournir de la L-méthionine avant que le prochain acide aminé puisse être attaché.
Les protéines consistent en une chaîne d'au moins 100 acides aminés protéinogènes, dont chacun est lié les uns aux autres via une liaison peptidique. En plus de son rôle en tant que composant de nombreuses protéines, la L-méthionine est le fournisseur de groupe méthyle le plus important pour la synthèse d'hormones telles que l'adrénaline, la choline, la créatine, l'histidine et bien d'autres. De plus, la L-méthionine est également une source de soufre pour la synthèse de certains composés dans l'organisme.
Fonction, effet et tâches
Dans sa forme L biochimiquement réactive, la méthionine remplit des fonctions de plus haut niveau dans le métabolisme du corps ainsi que des fonctions spécifiques. Une fonction superordonnée consiste essentiellement à former l'acide aminé initial d'une protéine.
Cela signifie que la synthèse des protéines s'arrête s'il n'y a pas assez de L-méthionine disponible dans le corps. Dans de nombreux cas, cependant, la méthionine est séparée et recyclée après que la synthèse protéique a été initiée, de sorte qu'elle est à nouveau disponible pour la synthèse protéique suivante. Dans certaines protéines structurales en particulier, la L-méthionine est un composant important qui influence la résistance structurelle des ligaments, des tendons et des fascias. La dureté des ongles et des orteils et la résistance des cheveux dépendent également du nombre de ponts soufrés dans la kératine, de sorte que la méthionine est ici d'une grande importance.
La méthione peut traverser la barrière hémato-encéphalique relativement facilement et est impliquée dans la formation des gaines de myéline des nerfs - également dans le SNC. L'excès de méthionine qui n'est pas directement nécessaire peut être converti en S-adénosylméthionine (SAM) en l'ajoutant à l'ATP (adénosine triphosphate) et agir comme un donneur de groupe méthyle (-CH3). Après avoir libéré le groupe méthyle, la méthionine peut à nouveau être recyclée et est disponible pour d'autres processus métaboliques. L'excès de méthionine peut être décomposé et métabolisé dans une certaine mesure en plusieurs étapes.
Des doses supplémentaires de méthionine conduisent par le processus de dégradation physiologique à une acidification délibérée de l'urine, qui, dans le cas d'infections des voies urinaires, inhibe la croissance bactérienne et renforce l'effet des antibiotiques administrés. Les calculs de phosphate de calcium et de phosphate de magnésium et d'ammonium peuvent également se dissoudre à nouveau en raison du faible pH de l'urine.
Éducation, occurrence, propriétés et valeurs optimales
La méthionine est un acide aminé essentiel, elle doit donc être fournie de l'extérieur par les aliments. De nombreux aliments, d'origine animale et végétale, contiennent de la méthionine, mais pas sous forme libre, mais toujours liés à des protéines.
Les aliments contenant des quantités significatives de méthionine liée sont z. B. bœuf cru, saumon cru, graines de sésame, soja séché et de nombreux autres aliments, y compris les aliments à base de plantes. Avec plus de 1000 mg de méthionine pour 100 g, les noix du Brésil ont même une teneur presque deux fois plus élevée que le saumon cru. Les protéines sont digérées dans l'intestin grêle. Les protéines sont en grande partie décomposées en plus petits morceaux (polypeptides) par des peptidases spécialisées et absorbées via les petites villosités intestinales.
Avec une alimentation équilibrée, on peut supposer qu'une quantité suffisante de méthionine est consommée. Les indications pour des quantités optimales varient un peu. Comme valeur de référence, un besoin humain d'environ 13 à 16 mg par kilogramme de masse corporelle peut être supposé. Une personne de poids normal avec une masse corporelle de 75 kg est donc dépendante d'un apport quotidien en méthionine de l'ordre de 975 à 1 200 mg.
Vous pouvez trouver votre médicament ici
➔ Médicaments contre la faiblesse musculaireMaladies et troubles
L'acide aminé essentiel méthionine sert de matière de départ à de nombreux processus métaboliques complexes, de sorte que les perturbations de certains processus de conversion dues au manque de certaines enzymes peuvent entraîner des symptômes parfois graves. Une carence en méthionine conduit également à une carence en S-adénosyl méthionine (SAM).
Le manque de MAS est lié, entre autres, au développement de la stéatose hépatique et à la promotion de la dépression. Certaines perturbations du métabolisme méthionine-cystéine, déclenchées par une carence en certaines enzymes, conduisent à une accumulation excessive du produit intermédiaire homocystéine. La cause la plus connue de l'homocystinurie, comme on l'appelle l'accumulation d'homocystéine, est un défaut génétique qui provoque une carence en cystathionine bêta synthase.
L'excès d'homocystéine favorise la formation de thromboses et a des effets négatifs sur le tissu conjonctif, principalement sur le squelette et les yeux, de sorte qu'il existe un risque de changement de position des verres oculaires (ectopie du cristallin). L'homocystinurie affecte également les processus mentaux. Lorsque le trouble métabolique de la méthionine entraîne une carence en cystéine, il se produit également une carence en glutathion et en taurine, qui ont des fonctions de protection importantes sur les nerfs. Un lien entre la carence en cystéine et la progression de la maladie d'Alzheimer et de la maladie de Parkinson a été établi.








.jpg)

.jpg)