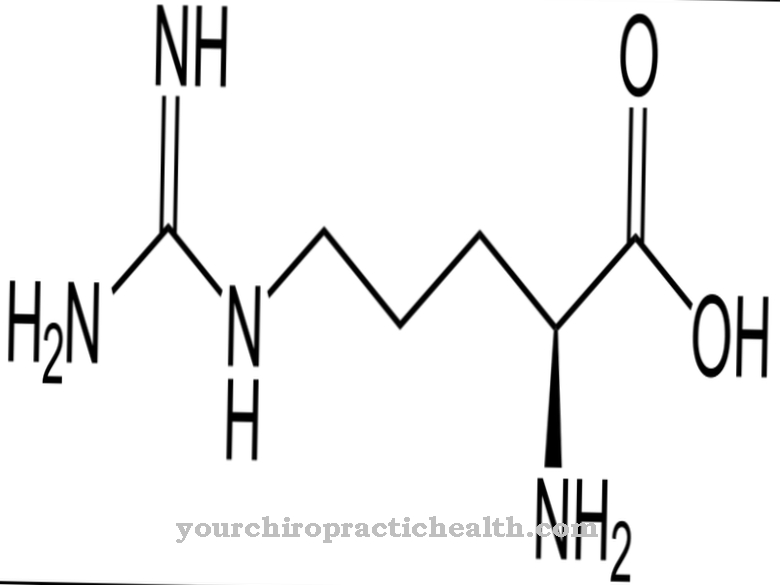
Plasmin est une enzyme de séparation des protéines dans le sérum sanguin humain, qui est formée à partir du plasminogène précurseur. Sa tâche principale est la fibrinolyse et donc la décomposition des caillots sanguins par l'organisme. Une hyperactivité de la plasmine peut conduire à une tendance au saignement et une sous-activité à une tendance au thrombus.
Qu'est-ce que la plasmine
Le sérum sanguin humain contient diverses protéines et enzymes. Les enzymes sont constituées de molécules biologiques géantes et agissent comme des catalyseurs pour accélérer les réactions chimiques. Presque toutes les enzymes du sang humain sont des protéines formées par la biosynthèse des protéines des ribosomes.
Les enzymes ont une grande variété de tâches dans l'organisme. En fonction de leur fonction, ils sont davantage classés. Les peptidases sont, par exemple, un groupe d'enzymes qui clivent des peptides ou des protéines. De cette manière, ils catalysent l'hydrolyse des composés peptidiques. Les peptidases sont également appelées enzymes protéolytiques. Une telle enzyme protéolytique est la plasmine. Il se produit dans le sérum sanguin et y décompose diverses protéines. La dégradation des protéines du sérum relève également de son domaine de responsabilité. La plasmine est formée à partir du plasminogène précurseur.
Fonction, effet et tâches
La fonction principale de la plasmine est de décomposer la fibrine. Cette soi-disant fibrinolyse joue un rôle en particulier pour les caillots sanguins. Au cours de ce processus, la plasmine dissout les caillots sanguins de l'organisme en décomposant les polymères de fibrine du thrombus en produits de dégradation de la fibrine.
La fibrinolyse est régulée en neutralisant les processus biochimiques. L'activation a lieu en convertissant le plasminogène inactif en plasmine active. La fibrinolyse fonctionne avec la coagulation du sang, mais progresse beaucoup plus lentement. Deux activateurs endogènes sont impliqués dans l'activation de la fibrinolyse: l'activateur tissulaire du plasminogène et l'urokinase. En tant qu'activateurs non physiologiques, la staphylokinase et la streptokinase sont impliquées dans l'activation de la plasmine.
Les activateurs exogènes forment un plus grand complexe avec le plasminogène et la plasmine, qui active le plasminogène inactif. PAI-1 à PAI-4 apparaissent comme des inhibiteurs de l'activation de la fibrinolyse. Après activation, la plasmine clive les polymères de fibrine. Il se lie à la fibrine et sépare les polymères de fibrine ramifiés en produits de dégradation solubles de structure et de masse différentes. La circulation sanguine emporte les substances solubles jusqu'à ce qu'elles soient évacuées de la circulation sanguine.
Pour désactiver la fibrinolyse, le corps utilise l'inhibiteur de la plasmine alpha-2 inhibiteur de la plasmine. La plasmine liée à la fibrine a une demi-vie relativement longue par rapport à cette antiplasmine. La plasmine libre dans le sérum est rendue inoffensive en très peu de temps par l'inhibiteur.
La plasmine assume ainsi des tâches importantes dans le système de coagulation et apparaît comme un adversaire de la thrombine. En plus de la fibrine, le fibrinogène de stade préliminaire est également décomposé par la plasmine et son stade préliminaire. Les sérine protéases comme la plasmine ont un effet irréversible et ne catalysent pas les réactions biochimiques dans les deux sens. La plasmine a un effet autocatalytique et convertit d'autres molécules en plasmine active.
Sa proenzyme est donc un substrat de l'activation. Outre son activité fibrinolytique, la plasmine décompose également des protéines telles que les collagénases activées. De plus, il active divers médiateurs dans le système du complément et amincit la paroi des follicules de Graaf pendant l'ovulation.
Éducation, occurrence, propriétés et valeurs optimales
La plasmine est produite à partir du plasminogène au stade préliminaire. Il est synthétisé dans le foie puis libéré dans la circulation sanguine, où il peut être mesuré. Le plasminogène a une demi-vie de plus de deux jours. La plasmine libre peut à peine ou pas du tout être détectée dans le sang. Seul le plasminogène peut être déterminé. La détermination a généralement lieu dans le sang citraté. Les valeurs normales de l'activité du plasminogène sont comprises entre 85 et 110 pour cent. La valeur standard de la concentration en plasminogène est de 0,2 g par litre.
Le plasminogène devient la plasmine, qui, comme l'élastase et la trypsine, correspond à une endopeptidase. L'activation du plasminogène en plasmine se fait par diverses substances. Les plus importants sont le tPA, la thrombine, le facteur XII et la fibrine. Dans le cadre du sous-groupe de peptidases sérine protéase, la plasmine a un centre actif. Dans ce centre actif, les sérine protéases portent une triade catalytique dans laquelle est impliquée l'acide aminé sérine. La triade catalytique d'acide aspartique, d'histidine et de sérine contient des résidus d'acides aminés liés par des liaisons hydrogène.
Maladies et troubles
Une maladie liée à la plasmine est le déficit en inhibiteur 1 de l'activateur du plasminogène. Cette carence congénitale conduit à la dissolution prématurée des caillots sanguins, qui se manifeste par une tendance à saigner.
PAI-1 apparaît dans le corps sain comme un inhibiteur de l'activateur du plasminogène de type tissulaire, car il joue un rôle dans la fibrinolyse intravasculaire. Les saignements spontanés sont rarement un symptôme de la maladie. Néanmoins, un traumatisme mineur peut provoquer des saignements aux genoux, aux coudes, au nez ou aux gencives. Les saignements menstruels sont souvent augmentés. De longues périodes de saignement après la chirurgie sont souvent observées chez les patients. S'il n'y a qu'une carence partielle en inhibiteurs, les saignements sont moins fréquents. Il peut également y avoir aucun saignement ou seulement un léger saignement.
Chez certains patients, la protéine inhibitrice est présente mais ne fonctionne pas. La cause est une mutation des allèles associés. La maladie de l'état homozygote est basée sur une transmission autosomique récessive.Le test d'anticorps ELISA ou l'analyse de la fonction PAI-1 permet de poser le diagnostic. Des inhibiteurs de fibrinolyse tels que l'acide epsilon-amino-caproïque ou l'acide tranexamique sont administrés au patient comme contre-mesure pour prévenir les saignements.
Une activité réduite de la plasmine liée à une mutation est l'opposé de la maladie décrite et peut favoriser une tendance thrombotique. La médecine moderne suppose également que la dégradation du tissu conjonctif par l'enzyme plasmine joue un rôle important dans la propagation de diverses maladies. Les maladies associées comprennent désormais le cancer, les maladies cardiovasculaires et l'inflammation.


.jpg)






.jpg)

.jpg)